
Лекція № 2
Розділ 1. Математична теорія виникнення і розвитку горіння та вибуху
Тема лекції (заняття № 1.3):
«Хімізм процесу горіння»
Лекцію розробив професор Єлагін Георгій Іванович
Література:
Єлагін Г. І., Шкарабура М. Г., Кришталь М. А., Тищенко О. М. Основи теорії розвитку і припинення горіння, ч. I. – Черкаси: ЧІПБ, 2005. – 276 с.
Єлагін Г. І., Шкарабура М. Г., Тищенко О. М. Методичні вказівки до виконання контрольних робіт з дисциплін «Теорія розвитку і припинення горіння» та «Теоретичні основи пожежовибухонебезпечності» для слухачів заочної форми навчання. – – Черкаси: ЧІПБ, 2006. – 63 с.
Демидов П.Г., Шандыба В.А., Щеглов П.П. Горение и свойства горючих веществ.
1. Обмін електронами при горінні і розкладі
хімічних речовин
2. Складання хімічних рівнянь процесів горіння та
розкладу
3. Матеріальний баланс процесів горіння та розкладу
1. Обмін електронами при горінні і розкладі хімічних речовин
Валентність показує скільки електронів даного атому можуть приймати участь у створенні електронних пар, тобто у створенні хімічних зв’язків.
Гідроген завжди одновалентний, оксиген - двовалентний, карбон - 2 або 4 i т.д.
Наприклад, молекула водню має такий вигляд:
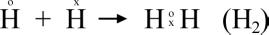
Н-Н,
молекула азоту:
![]()
N≡N.
На зовнішньому енергетичному рівні атома карбону перебувають чотири електрони.
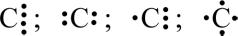
Важливо, що їх чотири i валентність карбону, отже, чотири. З гідрогеном карбон утворює метан СН4,
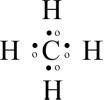 ,
,
Н
Н – С – Н
– С – Н
Н
з хлором може утворитися карбон тетрахлорид (чотирихлористий вуглець) СCl4:
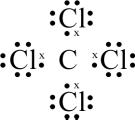
а може, припустимо, хлороформ: CHCl3:
 .
.
При пожежах вуглець утворює сполуки карбону з оксигеном. При повному згорянні вуглець дає вуглекислий газ СО2, при неповному – чадний газ СО:
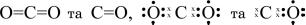
Рушійною силою кожної хімічної реакції є намагання хімічних елементів створити енергетичновигiдну зовнішню електронну орбіту.
Процес горіння - це реалізація реакції окиснення-вiдновлення.
Вибух (хімічний) – це або реалізація того ж процесу горіння, який дуже швидко проходить у кінетичному режимі, або реалізація процесу розкладу речовини.
Висновок з питання 1.
Хімічні зв’язки між атомами забезпечуються електронами зовнішніх орбіт атомів. Хімічна реакція відображає процеси обміну електронів. Горіння є різновидом хімічної реакції окиснення - відновлення. Вибух – різновид хімічної реакції розкладу речовини, або дуже швидкої реакції окиснення-відновлення.
2. Складання хімічних рівнянь процесів горіння та розкладу
Цифри вказують кількість атомів даного елементу в даній молекулі i кількість даних молекул в реакції:
Н2 ; СО2 ; CH4 ; C2H6 ; C2H4 ; C2H2 ; CHCl3 i т.д.
2H2 + O2 2H2O ;
C + O2 CO2 ;
CH4 + 2O2 CO2 + 2H2O.
Цифру знизу справа, що вказує на кількість атомів в молекулі, називають індексом.
Цифру перед молекулою (або атомом) називають стехіометричним коефіцієнтом. Якщо індекс, або стехіометричний коефіцієнт не поставлені, вважається, що вони дорівнюють одиниці.
Хімічні рівняння, які пишуться в курсі ТОП, практично не відрізняються від тих, що писалися в курсі ТРтаПГ.
У будь-якому випадку кількість атомів даного виду в лівій частині рівняння, тобто там, де відображено речовини, що реагують, повинна дорівнювати кількості атомів даного виду у правій частині, там, де відображено продукти реакції.
Як і в курсі ТРтаПГ, усі розрахунки ведуться відносно 1 кг-молю горючої речовини. Тому перед формулою горючої речовини не може бути ніякого коефіцієнту, стехіометричний коефіцієнт перед молекулою горючої речовини повинен завжди дорівнювати одиниці.
Натомість, перед молекулою окисника і перед молекулою кожного з продуктів реакції горіння або розкладу коефіцієнт може бути будь-який, навіть якщо це не ціле число, а наприклад 2,5 або 3,75 i т. ін.
Повітря складається з кисню, азоту та деяких домішок: аргону, гелію, вуглекислого газу, вологи.
Вважається, що повітря складається з азоту i кисню.
Кисню 23 % по масі, або 21 по об'єму;
Азоту 77 % по масі, або 79 по об'єму .
На 21 м3 кисню в повітрі припадає 79 м3 азоту. Або на 1 м3 кисню - 3,76 м3 азоту.
Згідно закону Авогадро, однакова кількість молекул будь-якого газу займає однаковий об'єм. Звідси, на кожну молекулу кисню в повітрі припадає 3,76 молекул азоту.
Алгоритм написання рівнянь. Спочатку реакцій горіння.
Перш за все пишуть молекулу горючої речовини
Н2 + 0,5 (О2 + 3,76 N2) = H2O + 0,53,76 N2,
потім записують знак "+" i умовну формулу молекули окисника, тобто молекулу кисню i з нею 3,76 молекул азоту.
Далі знак рівняння i продукти реакції, враховуючи азот.
Далі треба рахувати скільки атомів гідрогену, карбону i інших горючих елементів зліва i розставляти потрібні коефіцієнти справа.
Підбивши баланс по горючих елементах, переходять до кисню. Тут вже починають справа. Скільки справа атомів оксигену? Один. Скільки це молекул оксигену О2? Половина. В останню чергу рахують i пишуть коефіцієнт перед молекулою нітрогену.
Ще два приклади:
СН4 + 2 (О2 + 3,76 N2) = СО2 + 2 Н2О + 23,76 N2 метан
С2Н6 + 3,5(O2 + 3,76 N2) = 2CO2 + 3 H2O + 3,53,76N2
етан
Якщо до складу речовини, що горить, входить хлор, він здебільшого виділяється у вигляді НCl.
Нітроген, що входить до складу горючої речовини, і не з’єднаний з оксигеном, при горінні виділяється у вигляді чистого N2.
Сульфур згоряє в-основному до SO2.
Коефіцієнт перед "молекулою" повітря називається стехіометричним і позначається .
Вибух газоповітряних сумішей - це горіння в повітрі, яке проходить з великою швидкістю.
В цьому випадку складання рівняння реакції вибуху не відрізняється від попереднього.
Чисті вибухові речовини, такі як тринітротолуол, або гліцеринтринітрат розкладаються до цілком конкретних речовин. І ці речовини встановлені експериментально, а в задачах задаються.
Наприклад, нітрат амонію NH4NO3 при певних умовах розкладається з потужним вибухом.
При цьому, по деяких даних, на 1 молекулу вихідної речовини утворюються: 0,25 молекули амоніаку NH3, 1,625 молекули води, 0,125 молекули NО, 0,625 молекули кисню О2 та 0,8125 молекули азоту N2.
В курсах загальної хімії для складання рівняння реакції необхідно щоб усі стехіометричні коефіцієнти були цілими числами. Значить, в курсі загальної хімії рівняння реакції виглядало б наступним чином:
16NH4NO3 = 4NH3 + 26Н2О + 2NО + 10О2 + 13N2.
В нашому ж курсі рівняння пишеться для 1 молекули вихідної речовини, для 1 кг-молю:
NH4NO3=0,25NH3+1,625Н2О+0,125NО+0,625О2+0,8125N2.
Конденсовані сумішеві вибухові речовини, за основний компонент мають, або речовину, що здатна розкладатися з вибухом, або суміш твердого чи желеподібного відновника з твердим же або адсорбованим окисником. Решта – цільові добавки, які роблять вибухівку менш небезпечною у поводженні, попереджують її злежування, здатність зволожуватися і ін.
Спектр продуктів вибуху тут буде значно складніший. Крім газоподібних продуктів згоряння (окиснення) відновника, в продуктах вибуху опиняться і тверді, рідкі та газоподібні продукти відновлення окисника і продукти випаровування, плавлення та диспергування добавок.
Наприклад, динаміт є сумішшю головним чином глицерінтринітрату (до 25 %) і кізельгуру (до 75 %). Вибух динаміту дасть газоподібні продукти розкладу нітрогліцерину (карбон діоксид, нітроксиди, пари води і ін.) та пилоподібні залишки кізельгуру.
Висновок з питання 2
Рівняння реакцій горіння речовин в повітрі і рівняння вибуху складаються за загальними правилами написання рівнянь хімічних реакцій з двома особливостями:
1. Реакцію пишуть для 1 молю горючої речовини, або речовини, що розкладається.
2. Вважається, що при дифузійному горінні і кінетичному горінні (вибуху газоподібних горючих речовин) в повітрі окисником є суміш 1 молю оксигену і 3,76 молів нітрогену.
