
Специальность - ФАРМАЦИЯ |
Предмет – физическая и коллоидная химия |
Курс – второй |
Семестр – третий |
Лабораторная работа №3
|
|
Определение молекулярной массы неэлектролита криоскопическим методом
Раствором называется однофазная система, образованная не менее чем двумя компонентами и способная в известных пределах к непрерывному изменению состава. При этом некоторые свойства раствора изменяются, причем изменения зависят не от природы растворенного вещества, а от концентрации растворенного вещества независимо от его химического строения. Это свидетельствует, что растворенное вещество не реагирует с растворителем. Такие свойства раствора носят название коллигативных (слово "коллигативный" ("collig" - коллеги) означает "связанный друг с другом") и зависят от числа растворенных частиц. К ним относят:
понижение давления пара насыщенного пара над раствором;
повышение температуры кипения раствора - эбулиоскопия;
понижение температуры замерзания раствора - криоскопия;
осмос.
Основным из них является понижения давления насыщенного пара, а три остальные свойства вытекают из него как следствия.
Так как коллигативные свойства растворов зависят от числа растворенных частиц, то это позволяет определять с их помощью молярные массы веществ, наиболее точным из которых является криоскопический метод. Криоскопическим методом называется метод определения молярной массы вещества по понижению температуры замерзания его разбавленного раствора по отношению к чистому растворителю.
Криоскопический метод применяется для определения ряда физико-химических констант растворенного вещества, а также для изучения свойств растворов и биологических жидкостей (кровь, желудочный сок, спинномозговая жидкость, моча и др.).
Для растворов неэлектролитов методом криоскопии можно определить молярную массу растворенного вещества, для растворов электролитов и биологических жидкостей - осмотическую концентрацию и осмотическое давление, для разбавленных растворов электролитов - степень диссоциации, а, следовательно, и константу диссоциации растворенного вещества.
Физико-химические исследования показали, что депрессия (понижение температуры замерзания) крови человека характеризуется значительным постоянством: границы колебания нормальных величин депрессии составляет 0,55-0,58°. Величина депрессии 0,59° указывает уже на отклонение от нормы, а 0,60о на патологию. Устойчивое значение депрессии крови свидетельствует о постоянстве её осмотической концентрации. Разница депрессии венозной и артериальной крови составляет 0,01-0,02° и зависит от степени обогащения венозной крови углекислотой и другими продуктами обмена.
Ненормально высокие величины депрессии крови наблюдаются при расстройствах циркуляции со стороны сердца, легких, при заболеваниях почек и при нарушении деятельности нервной системы. Ненормально низкие депрессии могут быть при беременности и тяжелых интоксикациях.
Показания депрессии мочи варьируются в более широком интервале от 0,1 до 3,5° .
Точность и простота метода криоскопии дают возможность применять его и в клинической практике.
В соответствии с законом Рауля упругость пара растворителя над раствором Р1 при любой температуре Т равна упругости пара чистого растворителя Р1°, умноженной на мольную долю растворителя в растворе, т.е.
![]() (1).
(1).
Так как в растворе Х1<1, то Р1< Р1°.
Отсюда вытекают ряд важных следствий:
1 следствие – крисоскопический закон: температура замерзания раствора твердого вещества всегда ниже температуры замерзания чистого растворителя при условии, что замерзание сопровождается выделением из раствора чистого твердого растворителя (см. рис. 1):
![]()
![]() ,
,
где tзам. и ΔТзам – это изменение понижения температуры замерзания раствора по сравнению с растворителем, выраженное в градусах Цельсия и Кельвина, соответственно.

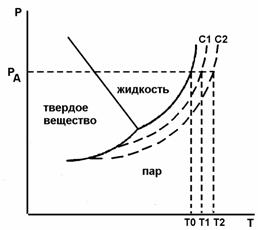
Рис.1. Диаграмма состояния воды и растворов с концентрациями С1 и С2 (криоскопия), T0, T1, T2 - температура замерзания
Рис.2. Диаграмма состояния воды и растворов с концентрацией С1 и С2 (эбуллископия) T0, T1, T2 - температуры кипения
Чем концентрированнее раствор, тем больше будет понижение упругости пара над раствором, тем больше должно быть и ΔТзам. Поэтому
![]() (2)
(2)
где К - криоскопическая постоянная, Сm - концентрация раствора в моль/1кг растворителя (моляльная концентрация).
Чистый растворитель и раствор из-за трудности начала кристаллизации склонны к переохлаждению, которое может составлять 1-2° С по сравнению с истинной tзам. При энергичном перемешивании переохлажденной жидкости начинает кристаллизоваться растворитель и температура ее повышается за счет выделения теплоты кристаллизации. Максимальные значения температуры, наблюдаемые при кристаллизации чистого растворителя и растворителя из раствора, принимают за температуру замерзания чистого растворителя и раствора соответственно.
Коэффициент К для каждого растворителя представляет величину постоянную и называется молярным понижением температуры замерзания или криоскопической постоянной. Численное значение К равно Δtзам., когда Сm равна 1 моль на 1 кг растворителя (одномоляльный раствор).
2 следствие – эбуллиоскопический закон: температура кипения раствора твердого вещества всегда выше температуры кипения чистого растворителя при одном и том же давлении.
Эбуллиоскопия - увеличение температуры кипения раствора, по сравнению с чистым растворителем (см. рис. 2):
![]()
![]()
![]() (3)
(3)
где Сm – концентрация раствора в моль/1000 г. растворителя (моляльная концентрация), Е - эбулиоскопическая постоянная. Эбуллиоскопическая константа равна изменению температуры кипения одномоляльного раствора по сравнению с растворителем.
3 следствие. Осмос - явление одностороннего перехода молекул растворителя в раствор через пористую полупроницаемую перегородку (мембрану) в область большей концентрации растворенного вещества. Осмотическим давлением называется то наименьшее давление, которое необходимо приложить к раствору для того, чтобы предотвратить перетекание растворителя через мембрану в раствор с большей концентрацией вещества.
Молекулы растворителя, как и молекулы любого другого вещества, приводятся в движение силой, возникающей вследствие разности химических потенциалов. Когда какое-либо вещество растворяется, химический потенциал растворителя уменьшается. Поэтому в области, где концентрация растворенного вещества выше, химический потенциал растворителя ниже. Таким образом, молекулы растворителя, перемещаясь из раствора с меньшей в раствор с большей концентрацией, движутся в термодинамическом смысле «вниз», «по градиенту».
В растворах, в которых содержится смесь электролитов, а к таким растворам относятся все биологические жидкости, расчет числа кинетически самостоятельных частиц затруднен. В связи с этим в медицине применяются такие понятия, как осмоляльность и осмолярность.
Под осомлярностью
(и осмоляльностью)
понимают активную
концентрацию частиц, не проникающих
через идеальную полупроницаемую
мембрану. Единицы
измерения осмолярности совпадают с
единицами измерения молярной концентрации,
а осмоляльности – моляльной концентрации.
Для разбавленных растворов можно
принять, что численные значения
осмоляльности и осмолярности совпадают.
Фактически осмоляльность и осмолярность,
определяемые математически как
![]() и
и
![]() соответственно,
являются эмпирическими величинами,
использование которых позволяет учесть
разные по характеру отклонения от
закона Рауля, возникающие в случае
неидеальных растворов.
соответственно,
являются эмпирическими величинами,
использование которых позволяет учесть
разные по характеру отклонения от
закона Рауля, возникающие в случае
неидеальных растворов.
Осмотическое давление крови зависит от концентрации в плазме крови молекул растворенных в ней веществ (электролитов и неэлектролитов) и представляет собой сумму осмотических давлений содержащихся в ней ингредиентов. Осмотическое давление крови , создаваемое белками крови, называют онкотическим давлением. При этом свыше 60% осмотического давления создается хлористым натрием, а всего на долю неорганических электролитов приходится до 96% от общего осмотического давления. Осмотическое давление является одной из жестких гомеостатических константа и составляет у здорового человека в среднем 7,6 атм с возможным диапазоном колебаний 7,3–8,0 атм. Если жидкость внутренней среды или искусственно приготовленный раствор имеет такое же осмотическое давление, как нормальная плазма крови, подобную жидкую среду или раствор называют изотоническим. Соответственно, жидкость с более высоким осмотическим давлением называется гипертонической, а с более низким – гипотонической.
Осмотическое давление можно рассчитать с помощью закона Вант-Гоффа:
![]() (4)
(4)
где
СМ
- концентрация раствора в моль/л раствора
(молярная концентрация), R
- универсальная газовая постоянная,
![]() ,
T -
температура, K.
,
T -
температура, K.
Все рассмотренные выше зависимости применимы только к разбавленным растворам неэлектролитов.
Цель работы: определить молекулярную массу глюкозы криоскопическим методом.
Оборудование:
Прибор для криоскопических измерений
Весы лабораторные
Стакан на 150 мл (или колба)
Термометр с ценой деления 0,1С
Реактивы:
Охлаждающая смесь (лед и поваренная соль)
Глюкоза
Дистиллированная вода
