
- •3. Газовые законы. Закон объемных отношений Гей-Люссака.
- •Молярный объём газа – это объем газа в котором содержится 1 моль частиц этого газа
- •7. Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы. Изотопы.
- •8. Квантово-механическая модель атома.
- •15. Типы химических связей.
- •17. Метод валентных связей. Гибридизация атомных орбиталей и геометрия молекул. Полярность молекул. Пространственное строение молекул bf3, h2o, ch4.
- •20. Металлическая связь. Понятие электронного газа. Проводники, полупроводники, диэлектрики.
- •24. Понятие о координационном числе центрального атома и дентатности лигандов. Хелаты.
- •23. Диссоциация комплексных соединений. Ступенчатая диссоциация комплексных ионов. Общая (полная) константа нестойкости комплексных ионов как мера их устойчивости.
- •22. Комплексные соединения. Структура. Классификация. Номенклатура.
- •46. Степень окисления элементов и правила её определения. Примеры определения степени окисления в соединениях, содержащих более двух различных элементов.
- •Ряд активности металлов.
- •34. Понятие об энергии активации. Уравнение Аррениуса. Катализаторы.
- •30. Оксиды, их классификация. Виды связей. Химические свойства.
- •Основные химические свойства:
- •35. Общие представления о растворах. Растворимость газа в жидкости, растворимость жидкости в жидкости. Растворимость твердого тела в жидкости.
- •40. Труднорастворимые электролиты. Равновесие раствор-осадок. Произведение растворимости. Связь растворимости и произведения растворимости на примере BaSo4.
- •39. Ионное произведение воды. Водородный показатель. Определение pH водных растворов сильных и слабых электролитов.
- •45. Способы выражения количественного состава растворов.
3. Газовые законы. Закон объемных отношений Гей-Люссака.
В 1811г.итальянский физик Авогадро объяснил простые отношения между объёмами гахов,наблюдающиеся при хим.реакциях,установив закон Авогадро:В равных объёмах различных газов при одинаковых внешних условиях содержится одинаковое число молекул.Этот закон вводил в науку представление о молекулах как о мельчайших частицах вещ-ва.Закон Авогадро позволил сделать выводы о числе атомов в молекулах газов.
Закон Бойля-Мариоота:Для данной массы газа произведение давления на объём есть величина постоянная при неизменной температуре.
Первые количественные исследования между газами принадлежат фр.учёному Гей-Люссаку.Измеряя объёмы газов,вступающих в реакцию и образующихся в результате реакции,Гей-Люссак пришёл к обобщению,известному под названием закона простых объёмных отношений Гей-Люссака:Объёмы вступающих в реакцию газов относятся друг к другу и к объёмам образующихся газообразных продуктов реакции как небольшие целые числа.
Измерения объёмов газов обычно проводят при условиях,отличных от нормальных.Для приведения объёма газа к нормальным условиям можно пользоваться объединённым газовым законом: PV/T=P V /T
Мольные массы газов можно вычислить,пользуясь уравнением состояния идеального газа-уравнение Квайперона-Менделеева: PV=mRT/M
Объединенный газовый закон:

р0 = 101325 Па, Т0 = 0 ºС (273,15 К),
где р0, V0, Т0 – соответственно давление, объем, температура при н.у.; р, V, Т – те же параметры данного количества газообразного вещества при других условиях.
Для 1 моль любого
газа при н.у.:
 - универсальная газовая постоянная.
- универсальная газовая постоянная.
R = 8,314 Дж/(мольК)
Для 1 моля газа тогда имеем:

Это уравнение состояния идеального газа.
Если количество газа другое, то получим уравнение Менделеева – Клапейрона:
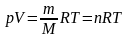 (n
– число молей данного вещества).
(n
– число молей данного вещества).
Закон парциальных давлений: общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь:

где р – общее давление; р1, р2 … - парциальные давления газов 1, 2 …
Парциальное давление газа в смеси – давление, которое производило бы это же количество данного газа, если бы он один занимал при этой же температуре весь объем, занимаемый смесью.
4. гипотезы Авогадро. Следствия из закона авогадро. Уравнение Клапейрона-Менделеева.
Закон Авогадро: В равных объемах разных газов при одинаковых условиях (давлении и температуре) содержится равное количество молекул.
Гипотезы Авогадро: 1. В равных объемах разных газов при одинаковых условиях (давлении и температуре) содержится равное количество молекул.
2. Молекулы, простых газообразных веществ, таких, как водород, кислород, азот, хлор и др., состоят из двух атомов.
Обе гипотезы Авогадро получили опытное подтверждение в газовой химии. Первая гипотеза превратилась в один из основных законов идеальных газов, имеющих первостепенное значение для химии.
Следствия: 1. При одинаковых условиях 1 моль любого газа занимает одинаковый объем. Моль любого газа при нормальных условиях B73 К и 1,033-105 Па) занимает объем 22,4 л. В условиях, отличных от нормальных, объем любого количества газа может быть рассчитан из уравнения Клапейрона-Менделеева : pV=m/(MRT), где м — масса газа; М — молекулярная масса; R — молярная газовая постоянная; р — давление; Т — абсолютная температура; V — объем газа, а m/М — n — число
молей.
2. молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму. Положение это имело громадное значение для развития химии, так как оно дает возможность определять частичный вес тел, способных переходить в газообразное или парообразное состояние. Если через m мы обозначим частичный вес тела, и через d — удельный вес его в парообразном состоянии, то отношение m / d должно быть постоянным для всех тел.
5. Основные понятия химии
Моль
– количество вещества, содержащее
столько структурных элементарных
единиц (атомов, молекул, ионов, электронов,
эквивалентов и т. д.), сколько содержится
атомов в 0,012 кг изотопа углерода
 .
.
Количество вещества – число структурных элементов в системе.
