
1. Химическая кинетика – наука о скорости и механизме процесса. Его зависимости от разл. факторов, позв. Ускорить или замедлить ход реакции.
Система – рассматриваемое в-во или совокупность в-в, отграниченное от среды.
Фаза – часть системы, отделенная от других ее частей поверхностью раздела.
Процесс реакции – ход реакции.
Механизм р-ции - это совокупность стадий, в результате к-рых исходные в-ва ревращаются в продукты.
Скорость хим. реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Средняя
скорость :
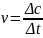
Истиная скорость – скорость в данный момент времени.
2. Гомогенная
р-ция
- сост. из одной фазы (идет во всем объеме
системы).
Гетерогенная
р-ция
– сост. из нескольких фаз (идет на
поверхности раздела фаз).

Стадии гетерогенной р-ции: дифузия к поверхности раздела фаз→абсорбция (осождение) на поверхности→хим.р-ция→десорбция (удаление) продуктов р-ции→ дефузия по всему объему
Факторы вл. на скорость р-ции: конценрация в-в, температура(опред. Правилом Вант-Гоффа), величина реаг. Поверхности.
Основные
правила:
1)ЗДМ выполню только для простых р-ций.
Скорость сложной опред. Скоростью самой
медленной стадии(лимитирующей). 2)
скорость р-ции твердых в-в постоянна
из-за постоянной концентрации (конц.
Включена в константу скорости) поэтому
 .
.
3. Закон действующих масс - скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
 (Р-порц.
давление, С-концентрация)
(Р-порц.
давление, С-концентрация)
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
4. При увеличении температуры, скорость р-ции увеличивается.
Правило Вант-Гоффа - при повышении температуры на 10° С скорость реакции увеличивается в 2-4 раза.
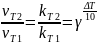
Где
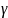 – показывает во сколько раз увел.
скорость при вовышении темп. На 10 град.
Цельсия. Зависит от температуры в-ва и
катализатора.
– показывает во сколько раз увел.
скорость при вовышении темп. На 10 град.
Цельсия. Зависит от температуры в-ва и
катализатора.
Уравнение
Аррениуса:
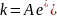 →
→
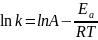
5.
Энергия
активации-
мин. доп. энергия которую нужно сообщить
средней энергии частиц, чтобы произошло
взаимодействие.
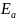 всегда > 0.
всегда > 0.
Анализ ур-я Аррениуса:
1)позв.
рассчитать как измен.
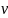 р-ции при измен. температуры и
р-ции при измен. температуры и
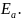
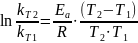

2) скорость р-ции при пост. конц. Возрастает с увелич. температуры по экспоненциальному закону
3) чем больше значение энергии активации, тем меньше скорость р-ции.
6. Энергетич. диаграмма р-ций –описание хода р-ции через изменение энергии исзодн. в-в.

Активный комплекс- группа взаимод. частиц в момент соударения: старые связи ослаблены, новые наметелись но еще не образовались.
Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции.
7. Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении.
А2 + В2 ⇄ 2AB
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Факторы влияющие на усл. равновесия: температура, давление, концентрация.
Вывод константы равновесия:
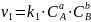 и
и
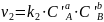
Т.к.
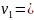
 →
→
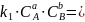
 →
→
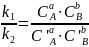 →
→
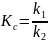 →
→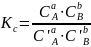
8.
т.к.
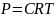 и
и
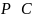 то
то
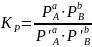
Взаимосвязь
выражается так:
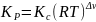 , где Δν – изменение числа молей
газообразных веществ в течение реакции.
, где Δν – изменение числа молей
газообразных веществ в течение реакции.
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары:
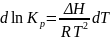
и изохоры химической реакции:
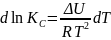
9. В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Смещение химического равновесия: 1) в следств. изм. концетрации какого-либо из в-в, уч. в р-ции.
2) в следств. изм. давления. 3) в следств. изм. температуры.
Принцип Ле-Шателье - если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
1) при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры.
2) При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
3) При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции и наоборот
10. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
1) При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
2) При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
11. Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры.
N2 + 3H2 2NH3 + Q
12. Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом, для нее справедливы законы термодинамики.
Параметры: температура, давление, объём, энтропия.
Т/д сост. системы описывается функциями сост. которые опред. через параметры сост. P,V,T. Изменение хотябы одного из них влечет за собой изм. всех. Ф.С. не зависят от пети и времени процесса, а опред. только начальным и конечным сост. системы.
13. I з/т - Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
Изохорный:
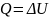 ,
изобарный:
,
изобарный:
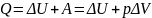
Вну́тренняя эне́ргия — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы (не связанная с пространственным положением или движением тела).
Энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении (полная энергия расширенной сист. в изобарно-изотерм. условиях)

14. Тепловой эффект – количество теплоты, выделяющееся при р-ции.
Стандартная энтальпия- тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
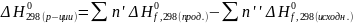 ,
где n-стехиометрический
коэфицент.
,
где n-стехиометрический
коэфицент.
15. Закон Гаусса - тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Закон Лавуазье-Лапласа— при разложении сложного вещества на простые поглощается (или выделяется) столько же теплоты, сколько ее выделяется (или поглощается) при образовании того же количества вещества из простых веществ.
Расчет теплового эф-та: исп. ур-е Каргофа
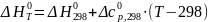 ,
где
,
где
 (или
в табл.)
(или
в табл.)
16-17. Второе
начало термодинамики
гласит, что невозможен самопроизвольный
переход тепла от тела, менее нагретого,
к телу, более нагретому.

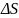 -
изменение
энтропии-
мера беспорядка системы (физ.см.:
-
изменение
энтропии-
мера беспорядка системы (физ.см.:
 )
)
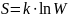 по
ур-ю Больцмана (k=1.38e23,
W-число
микросост., которыми можно реализовать
данное макросост.)
по
ур-ю Больцмана (k=1.38e23,
W-число
микросост., которыми можно реализовать
данное макросост.)
S зависит от природы в-ва, его агрег. сост., числа частиц, температуры
В
стандартн.
условия:

При
заданной температуре:
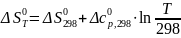
18. Основное ур-е т/д – объед. 1й и 2й законы т/д
Физ.
Смысл
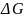 – это та часть энерг. эффекта, который
можно превратить в работу в обратимом
процессе при P,T=const.
– это та часть энерг. эффекта, который
можно превратить в работу в обратимом
процессе при P,T=const.
При
станд. условиях: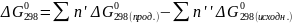
При
заданной температуре:
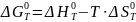
19-21. Энтальпия
и энтропия сваязаны через энкргию
Гиббса и температуру. Пренебрегая
зависимостью
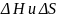 от температуры можно опред. температуру
наступления равновесия
от температуры можно опред. температуру
наступления равновесия
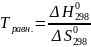 .
(Т/д
условия равновесия:
.
(Т/д
условия равновесия:
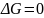 )
)
Уравнение
изотермы(саязь
между
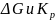 ):
):

Уравнение
изобары (саязь
между
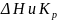 ):
):
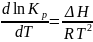 проинтегрировав
получим
проинтегрировав
получим
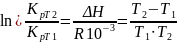
22. Электроли́ты— вещества, расплавы или растворы, которые проводят электрический ток вследствие диссоциации на ионы, однако сами вещества не проводят электрический ток.
Электролитическая диссоциация — процесс распада электролита на ионы.
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода.
Основания — сложные вещества, которые состоят из атомов металла и гидроксогруппы (-OH).
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла.
Степень диссоциации (α) – отношение числа его молекул, распавшихся на ионы к общ. числу молекул в р-ре. По величине α эл-ты делятся на слабые(α<<1) и сильные (α>>1).
23-24. Константа диссоц. – константа равновесия, отвеч. диссоциации слабого электролита.
Закон
разбавления Оствольда:
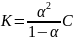 для α<<1,
для α<<1,
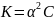 →
→
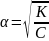
Электр.
диссоциация воды:
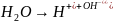 , откуда
, откуда
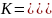 .
.
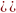 –нейтральный
р-р;
–нейтральный
р-р;
– кислый р-р;
– щелочной р-р.
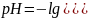 ;
;
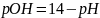 или
или
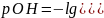 .
.
25. Для металлов характерно свойство растворяться в воде. При этом в воду переходят положит. заряженные ионы металла, в результате чего заряжается отрицательно. Гидратированные катионы металла скапливаются возле поверхности пластинки на границе раздела двух фаз (металл-раствор). Возникает двойной электрический слой, характеризующийся некоторой разностью электростатических потенциалов. Сост. равновесия зависит отактивн. Ме (конц. его ионов в р-ре)
Металлический электрод – металл, погруженный в раствор своей соли M|Mn+.
Газовый электрод - в качестве одного из компонентов электродной пары содержит газ.
26-28 Стандартный
электродный потенциал(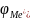 )
– потенц.
данного процесса при концентрациях
равных 1.
)
– потенц.
данного процесса при концентрациях
равных 1.
Электродом
сравнения явл. Водородный электрод:
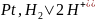
Роль платины: 1) Осущ. суобретательную абсорбцию молекул водорода. 2) Инертный носитель газа. 3) Котализирует диссоциоц. молекул газа. 4) Электрод 1-го рода: осущ. передачу эл-в во внешнюю цепь.
Li-Al –активные, Mn-Pb – средн. активн., H-Au – малоактивн.
Условия
протекания в.-о. р-уий: температура,
катализатор (если нужен), природа
реагирующих веществ,
 .
.
Ур-е
Нернста:
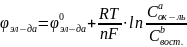
Cхема стандартного никеделевого эл-да: Ni|NiSO4 или Ni|Ni2+
