
білок
білок
гем С
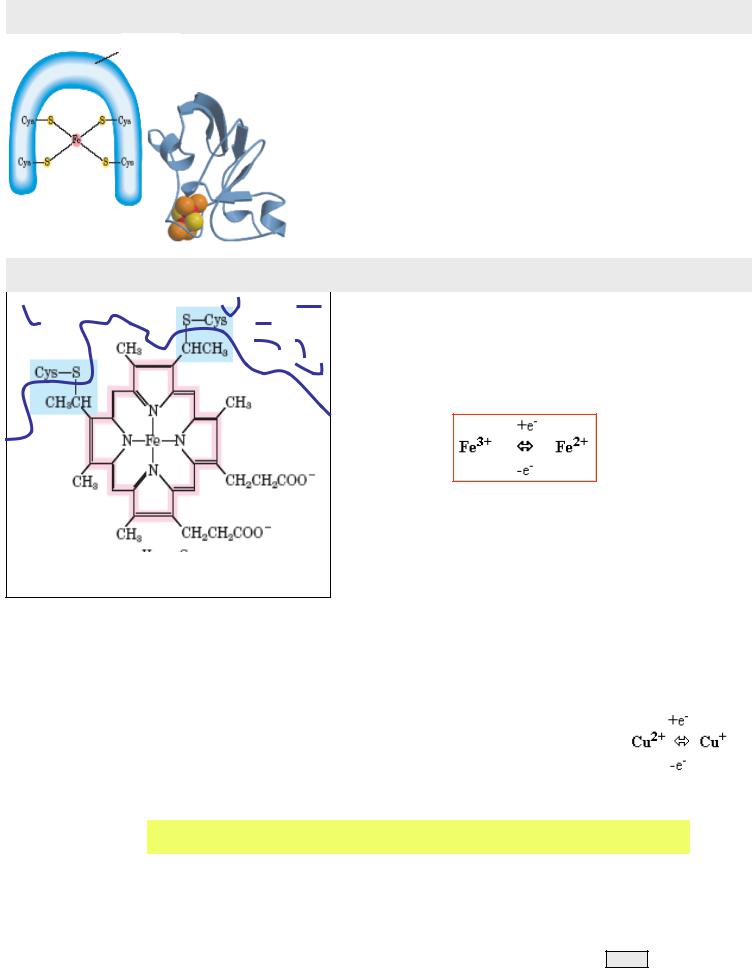
4. Залізо-сірчані білки (FeS – білки)
Це складні білки , котрі містять негемінове залізо та сірку. Ці білки локалізовані в ліпідному шарі мембран . Вони можуть зворотньо окиснюватися та відновлюватися, тобто переносити електрони.
Подібні окисно -відновні системи стабільні лише у складі білків. Вони можуть мати від 2 до 6 іонів заліза, котрі утворюють комплекси різного складу з неорганічним сульфідом і SHгрупами залишків цистеїну білкових молекул .
5. Цитохроми
Це складні білки – гемопротеїни, що містять гем - простетич ну групу , подібно до гему гемоглобіну. Гем містить гемінове залізо, здатне змінювати валентн ість, тобто переносит и тільки електрони.
Цитохроми відрізняються один від іншого як за складом білка, так і за замісниками у гемі.Вони мають різні фізико-хімічні властивості та
окисно -відновні потенціали.
В д ихальному ланцюзі цитохром и необхідні для перенесення електронів . Вони розташовані згідно з величинами їхніх окисно -відновних потенціалів наступним чином : цитохром b, цитохром с1, цитохром с, цитохроми а, а3.
Цитохром аа3 , або |
цитохромоксидаза, - це термінальный фермент , |
||
котрий переносит ь |
електрони безпосередньо на |
кисень (аеробний |
|
фермент ). Він складається з 6 субодиниць та, крім |
гемінового заліза, |
|
|
містить іони міді. У перенесенні електронів спочатку беруть участь іони |
|
||
заліза цитохромів а й а3, а далі - іон міді цитохрому а3. |
|||
Молекулярна організація ланцюгу перенесення електронів |
|
|
Усі учасники ланцюгу перенесення електронівструктурово об’єднані в чотири окисно - |
||
відновні системи – мультиферменті комплекси I – IV, вбудовані у ліпідний матрикс |
||
внутрішньої мембрани мітохондрій. |
|
|
Процес окиснення починається з перенесення протон ів і електронів |
з субстрата , що |
|
окиснюється ,на НАД+ або ФАД. Це залежить від природи субстрату. |
SH2 |
41 |
|
|
|

|
мембрана |
|
гліцерол- |
|
|
Комплекс I – НАДН -дегідрогеназа – |
|||||||||||
|
|
|
|
|
3- |
фосфат |
|
|
флавопротеїн, що містить ФМН. Цей фермент |
||||||||
|
|
|
|
|
|
|
|
|
|
|
окиснює |
|
НАДН і передає |
два атоми водню |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
ФАД |
(2Н+ 2е-) |
на ко ензим |
Q. |
Комплекс також |
||||||
|
Fe-S |
|
|
|
|
|
|
|
|
|
містить FeS-білки. |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Комплекс |
II |
– сукцинатдег ідрогеназа – |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
ФМН |
|
|
|
|
|
|
|
флавопротеїн, що містить ФАД. Цей фермент |
||||||||
|
|
|
|
|
ФАД |
|
ФАД |
окиснює сукцинат |
і транспортує два атоми |
||||||||
|
|
|
|
|
|
|
|
|
|
водню |
(2Н+ |
2е-) |
на ко ензим Q. У складі |
||||
НАДН |
НАД+ |
|
|
|
|
|
|
|
|||||||||
сукцинат |
|
|
|
|
комплекса присутні FeS-белки. |
||||||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
SH2 |
|
|
|
|
|
|
|
ацил-КоА |
У матрикс і мітохондрій також містяться й |
|||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
інші |
ФАД-залежні |
дегідрогенази, кот рі |
|||||||
|
ізоцитрат |
|
|
|
|
|
|
|
|
||||||||
|
піруват |
|
матрикс |
|
|
окиснюють відповідні субстрати (гліцерол-3- |
|||||||||||
|
малат |
|
|
|
|
фосфат , ацил-КоА) та далі передають атоми |
|||||||||||
|
глутамат |
|
митохондрії |
|
|
||||||||||||
|
|
|
|
водню на коензим Q. |
|
|
|||||||||||
|
та інші |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
Потоки атомів водню об’єднуються на стадії утворення відновленого КоQН2 .
Коензим Q є останнім компонентом ланцюгу, котрий здатний транспортувати не тільки протони, але й електрони (2Н+ 2е-). Дал і протон и (2Н+) переходят ь із внутр ішньої поверхні мембран и мітохондрії на зовнішню, а електрони (2е-) крізь ланцюг цитохромів переносяться на кисень.
Міжмембранний
простір
НАДНН НАД+ |
|
фумарат |
½ О2+2Н Н2О |
|
сукцинат |
|
|||
|
|
|
|
матрикс |
|
|
|
|
|
Комплекс III – уб іхінондегідрогеназа – це фе рментний комплекс , котрий включає цитохром b, FeS-білок і цитохром с1. Цей комплекс транспортує електрони 2е- від відновленого убіхінону КоQН2 на цитохром с (невеликий за розмірами водорозчинний білок, що міститься на зовнішній стороні внутрішньої мембрани).
Комплекс IV – цитохром с-оксидаза – ферментний комплекс , |
|
|
|
|||||
що складається з цитохромів а й а3. Ці ферменти здійснюють |
|
|
|
|||||
2е + ½ О |
|
О2- |
||||||
останню стадію б |
іологічного окиснення |
– в ідновлення |
2 |
|
|
|||
|
|
|
||||||
електронами (2е- ) молекулярного кисню: |
|
|
|
|
|
|
||
Відновлений кисень |
О2- реагує з вільними |
протонами (2Н+ ) |
матриксу. В результаті |
|||||
реакції утворюється ендогенна , або метаболічна , вода: |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
42 |
2Н+ + О2- |
|
|
Н О |
|
|
|
|
|
|
|
|
|
|
|||
|
|
2 |
|
|
|
|
||

Комплекс I |
|
|
Q |
Комплекс III |
|
|
|
|
|
Комплекс IV |
|
|
|
||
ФМН FeS |
|
|
b FeS c1 |
|
|
с |
|
|
a a3 |
|
|
1/2О2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
НАД+ |
|
|
|
|
Комплекс II |
2Н |
||
ФАД FeS |
|||
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н2О |
SH2 |
|
SH2 |
|
|||
|
|
|
||||
Напрямок перенесення протон ів і електронів визначають окисно -відновні потенц іали. Для забезпечення спонтанного перенесення компоненти окисно -відновного ряду повинні розташовуватися згідно зі збільшенням величин потенціалів .
-0,32
+0,82
О2
Редокс -потенціал пар и НАД+/НАДН = - 0,32 В, що свідчить про високу здатність віддавати електрони . Редокс-потенціал пари кисень/вода = + 0,82 В, що свідчить про високу спорідненість до електронів.
Загальна різниця редокс -потенц іалів дорівнює 1,14 В. Цьому відповідає зміна вільної енергії
G = - 220 кДж/моль. Ця загальна величина енергії реакції розподіляється на невеликі та більш зручні «пакети », величини котрих визначаються за різницею окисно -відновних потенціалів відповідних проміжних продуктів . Припускається , що цей розподіл на пакети забезпечує дихальному ланцюгу дивовижно високий вихід енергії , що складає приблизно 60%.
|
|
|
|
Дихальний ланцюг мітохондрій |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Н2О |
||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
энергія |
|
|
|
|
|
|
|
|
тепло |
|
АДФ + Ф |
|
|
АТФ |
|
|||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
При прох одженні по дихальному ланцюгу пари е лектронів в ивільняється
енергія, б ільша частина |
котрої (60%) розсіюється у вигляді тепла, а інша |
||
акумулюється у макроергічниз зв’язках АТФ, |
а саме поглинається в реакції |
||
синтезу АТФ-окисному |
фосфорилюванні . |
|
43 |

Це фосфорилювання називається окисним, т ому що енергія , що необхідна для утворення макроергічного зв’язку, генерується у процес і окис нення, тобто руху протонів і електронів по мітохондріальному ланцюгу транспорту електронів.
Механізм окисного фосфорилювання
міжмембранний
цит.с
простір
КоQ
|
|
фумарат |
|
½ О +2Н+ |
Н |
О |
|
|||
|
|
сукцинат |
|
2 |
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
НАДНН НАД+ |
|
|
АДФ+Ф |
|
|
|
||||
|
|
|
|
|
|
|
|
|
V |
|
|
матрикс |
|
|
|
|
|
|
|
||
|
|
синтез АТФ |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
хімічний |
|
електрохімічий |
|
|
|
|
потенціал рН |
|
потенціал ΔµН+ |
|
|
АТФ-синтаза |
|
Головні перено сники |
електронів, комплекси |
I, III, IV, використовуючи енергію |
||||
електронів , забезпечують перенесення протон ів Н+ із матрикс у у міжмембранний простір. В результаті змінюється значення рН та виникає протонний електрохімічний
потенціал ΔµН+ (хеміосмотична теор ія П. |
Мітчела). Саме цей потенц іал є |
рушійною силою синтезу АТФ із АДФ і Ф . |
Синтез АТФ поєднаний зі зворотним |
потоком протонів Н+ із м іжмембранного простіру у матрикс . Внутр ішня мембрана мітохондрій непроникна для цього поток у. Завдяки спеціальній ферментній системі , що називається протонноюАТФ-азою або АТФ-синтазою (комплексV), здійснюється зворотний рух протонів . Після досягнення певної величини ΔµН+ активується АТФ-
аза. В ній відкривається |
канал, крізь який протон и повертаються у матрикс із |
міжмембранного простіру, |
а енергія ΔµН+ використовується для синтезу АТФ. |
44 |
|

Кожний зі трьох комплексів (I, III, IV) забезпечує протонний градієнт, необхідний для активації АТФ-синтази та синтезу 1 молекули АТФ.
|
АТ |
АДФ + Ф |
Ф |
Комплекс I
ФМН FeS
НАД+ |
SH2 (P/O = 3)
піруват α-кетоглутарат ізоцитрат малат глутамат лактат
|
|
АТ |
|
|
АТ |
|
|
АДФ + Ф |
Ф |
|
АДФ + Ф |
Ф |
|
Q |
Комплекс III |
|
Комплекс IV |
|
||
b FeS |
c1 |
с |
a a3 |
О2 |
||
|
||||||
Комплекс II
ФАД FeS
SH2 (P/O=2)
сукцинат ацил-КоА гліцерол-3-фосфат
Коефіцієнт окисного |
фосфорил ю- |
|||
вання P/O – це відношення кількості |
||||
фосфорної кислот и (Р), |
котра була |
|||
використана на фосфорилюваня |
, у |
|||
розрахунку на один атом поглинутого |
||||
кисню (О). |
|
|
|
|
P/O залежить від ділянки |
вхождення у |
|||
ланцюг |
транспорт |
у |
електронів |
|
відновних |
еквівалентів H2 |
від |
||
субстратів SH2, що окиснюються .
Субстрати SH2, що окиснюються НАД-залежними дегідрогеназами
(піруват, α-кетоглутарат ,ізоцитрат , малат, глутамат , лактат,)мають більшу енргетичну цінність , тому що при їхньому окисненні утворюються3 молекули АТФ (P/O = 3). При
окисненні субстратів SH2 (сукцинату, ацил-КоА, гл іцерол-3-фосфату) |
ФАД- |
залежними дегідрогеназами утворюються 2 молекули АТФ (P/O=2). |
|
Усі описані процес и перен есення протон ів, е лектронів і синтез у АТФ (тканинного дихання та окис ного фосфорил ювання) щільно поєднані: вони відбуваються завжди одночасно . Їхня швидкістьтакож змінюється одночасно .
Процеси засвоєння їжі та синтезу АТФ повинні визначатися енергетичними потребами клітин , тобто синтез і використання АТФ повинні бути погодженими.
При збільшенні в |
клітині споживання АТФ по ідвищується швидкість надходження |
|||
АДФ в мітохондрії, |
що означає зростання швидкості синтезу АТФ. Це призводить до |
|||
збільшення швидкості транспорту |
протон ів: зростає швидкість дихання . Така |
|||
кореляція, |
а саме |
пришвидшення окисного фосфорил ювання та |
дихання при |
|
підвищенні концентрац ії АДФ наз |
ивається дихальним контролем . |
Дихальний |
||
контроль |
– це співвідношення |
АТФ / АДФ: при його зменшенні підвищується |
||
інтенсивність дихання . |
|
45 |
||
|
|
|
|
|

У деяких випадках |
поєднання фосфо- |
рилювання та дихання порушується , в |
|
мітохондріях виникає |
“неконтрольоване ” |
дихання . Це може бути спричинено
пошкодженням мембран мітохондрій, а
також дією речовин , котрі функціонально роз’єднують окиснення та фосфори - лювання – роз’єднувачів . Ці ліпофільні сполуки (2,4-динітрофенол , жирні кисло-
ти) здатні переносит и протон и крізь мембрану м ітохондрій, обминаючи АТФ-
синтетазу . Це призводить до |
знищення |
||
протонного град |
ієнту. Прикладом |
||
природного |
роз’єднувача є |
білок |
|
термогенін, кот |
рий функціонує як |
||
протонний канал |
у мітохондріях буро ї |
||
жирової тканини. |
За цих умов коефіцієнт |
||
Р/О зменшується, енергія розсіюється у
вигляді тепла .
1.Пощкодження мембрани
2.Рухомі танспортери
норадоеналін
жирні жир кислоти
3. Керований протонний канал
термо - генін
Інгібітори транспорту електронів і окисного фосфорилювання
1. Інгібітори, що блокують дихальний ланцюг завдяки зв’язуванню з певними ферментами або коферментами на р ізних ділянках ланцюгу . В результаті Р / Ознижується до нуля залежно від ділянки , де діє інгібітор:
а) ротенон |
( |
інсектицид ), |
барбітурати |
|
( снотворні), |
антибіотик пієрицидін А.
б) антиміцин (антибіотик).
в) CN-, CO, H2S.
Ротенон , барбітурати а)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КоQ |
|
цит.b |
|
цит.с |
|
цит.с |
|
цит.аа |
|
О |
|
|
НАДН |
|
|
|
|
|
|
|
|
|
2 |
||||||||
|
|
|
|
|
|
1 |
3 |
|
|
|||||||||
в)
антиміцин
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НАДН |
|
КоQ |
|
цит.b |
|
|
|
цит.с |
|
цит.с |
|
цит.аа |
|
О |
2 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
1 |
3 |
|
|
||||
с)
СN- или СО
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
НАДН |
|
КоQ |
|
цит.b |
|
цит.с |
|
цит.с |
|
цит.аа |
|
|
О |
2 |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||
1 |
3 |
|
|
|
|||||||||||
2. Інгібітори окисного фосфорилювання:
олігоміцин – антиб іотик, гальмує функц ію АТФ-синтетаз и (не д іє на тканинне дихання).
46

Загальні шляхи катаболізму
1. Окиснювальне декарбоксилювання пірувату
Це процес відщеплення СО2 від пірувату та перенесення ацетильного залишку на коензим А з наступним утворенням ацетил -КоА. Процес здійснюється за участю
мультиферментого піруватдегідрогеназного комплексу (ПДГ).
Комплекс складається з трьох ферментів (Е1 , Е2 , Е3) та п’яти кофакторів:
|
|
|
|
|
|
|
|
|
тіамінпірофосфат |
(ТПФ) |
простетичні групи щільно |
||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
ліпоєва кислота (ЛК), ФАД |
зв’язані з апоферментами |
|||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
ФАД |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
НАД+ |
коферменти легко дисоциюють від |
|||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
коензим А (HS-КоА) |
|
|
апоферментів |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
+НАД+ + НSКоА |
|
СО2+ацетил -SКоА+НАДН Н+ |
||
|
|
|
|
|
|
Піруват |
|||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О
Е1 –ТПФ: каталізує відщеплення СО2 від пірувату та перенесення гідроксіетильного залишку на ТПФ.
Е2 –ЛК: переносить гідроксіетильний залишок від ТПФ на простет ичну групу – ЛК,
При цьому дисульф ідний зв ’язок розривається , а ацетильн ий залишок |
і водень |
приєднуються до ЛК. Далі ацетильный залишок переносит ься з ЛК на |
НSКоА з |
утворенням ацетил-SКоА, а ЛК відновлюється до дигідро-ЛК. |
|
Е3-ФАД каталізує дегідрування дигідро-ЛК, котра знов окиснюється . Атоми водню
відновлюють ФАД. На |
останній стадії атоми водню переносят ься на НАД+ з |
утворенням НАДН Н+. |
47 |

2. Цикл трикарбонових кислот
Цикл трикарбонов их кислот |
(цикл Кребса , цитратн ий цикл ) – це |
циклічна |
послідовність ферментативн их реакц ій, внаслідок яких ацетил-SКоА, |
продукт |
|
катаболізму білків, ліпідів і |
вуглеводів, окис нюється до вуглекислого газу СО2 з |
|
утворенням атомів во дню (Н), що використовуються для в ідновлення перви ннних
акцепторів ланцюгу транспорту електронів: НАД+ і ФАД.
(С2)
(С6)
|
(С4) |
(С6) |
|
|
|
|
|
СО2 |
|
(С4) |
α- |
|
(С5) |
|
|
|
|
|
|
СО2 |
|
(С4) |
|
|
|
(С4) |
|
|
(С4) |
Метаболіти та |
ферменти ЦТК локал ізовані у матрикс і та внутрішній мембран і |
|
мітохондрій. Вони функціонально поєднані з мітохондріальним ланцюгом транспорту
електронів. Тому відновні еквіваленти |
(4 пар и атомів водню), що утворюються |
|
внаслідок окис нення метаболітів цикл у Кребса , завдяки первинним |
акцепторам |
|
НАДН Н+ і ФАДН2 передаються у дихальний ланцюг для відновлення атомів кисню О2 з утворенням молекул Н2О. За рахунок окисного фосфорилювання синтезуєтьсяАТФ.
Ацетил -КоА – «активна оцтова кислота » (містить 2 атоми вуглецю С2), утворюється
внаслідок окиснювального |
декарбоксил ювання |
пірувату. В пер |
|
шій реакц ії вона |
|||||
конденсується з |
чотирьохвуглецевим оксалоацетатом |
( С4) з утворенням |
|||||||
шестивуглецевого цитрат у (С6). Далі від цитрат у |
|
послідовно |
відщепляються два |
||||||
атоми вуглецю у вигляді двох |
молекул СО 2,. Внаслідок цього знов регенер ується |
||||||||
оксалоацетат (С4). Таким чином, сумарне рівняння ЦТК має наступний вигляд: |
|||||||||
48 |
СН |
СООН + 2Н О |
|
|
2 СО + 8Н |
|
|
||
|
|
|
|
||||||
3 |
|
2 |
|
|
|
2 |
|
|
|

1
SКоА конденсація
НSКоА
цитратсинтаза
8
дегідрування
оксалоацетат |
|
цитрат |
|
|
|
2 |
а |
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
|
|
||
|
дегідратація |
||||||
малат - |
ЦТК |
аконітаза |
|
|
|
|
|
дегідрогеназа |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
7 |
малат |
|
|
гідратація |
фумараза |
|
цис-аконітат |
|
НАДНН+ |
2в |
|
|
|
|
аконітаза |
|
|
|
гідратація |
|
|
|
ФАДН2 |
|
|
|
|
|
|
|
|
|
||||
фумарат |
|
|
|
|
ізоцитрат - ізоцитрат |
|
||||||||||
|
|
|
сукцинат - |
|
|
|
|
3 |
||||||||
6 |
|
|
|
|
|
|
дегідрогеназа |
|
|
|||||||
|
|
дегідрогеназа |
|
|
|
|
|
декарбокси - |
||||||||
|
|
|
|
|
|
|
|
|
||||||||
дегідрування |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лювання |
|
|
|
|
|
|
|
сукциніл- |
|
α-кето- |
СО2 |
|||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
глутарат - |
|
|
|
||||||
|
|
|
|
|
|
тіокіназа |
|
дегідрогеназа |
|
|
|
|||||
|
|
|
сукцинат |
|
|
|
|
|
|
|
|
|
||||
|
|
|
НSКоА |
|
SКоА |
|
НSКоА α-кетоглутарат |
|||||||||
|
|
|
|
ГТ |
|
|
|
|
|
|
|
|
||||
|
|
|
|
ГДФ+Ф |
|
СО2 |
|
|
|
|||||||
|
|
|
|
|
Ф |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
сукциніл SКоА |
|
|
|
|||||
|
|
5 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
субстратне |
|
|
|
|
|
|
|
|
окислительноене |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
фосфорилювання |
|
|
|
декарбокси-люванняирование |
49 |
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Енергетичний баланс ЦТК
У ЦТК при окис ненні однієї молекул и «активного ацетату» утворюються відновні коферменти: 3 молекули НАДН+Н+ і 1 молекула ФАДН2. Далі вони окис нюються у дихальному ланцюзі . За рахунок окисного фосфорилювання утворюється по 3 молекули АТФ на кожний НАДН+Н+ і 2 молекули АТФ – на ФАДН2. Таким чином, за рахунок окисного фосфорилювання утворюється 11 молекул АТФ (3х3 + 2х1 = 11).
Крім того, у циклі Кребса існує реакція субстратного фосфорилювання, в котрій за рахунок розщеплення макро ергічного зв ’язку субстрат у (сукциніл SКоА) утворюється нова макроергічна сполука - ГТФ. Далі ГТФ передає свій фосфат на АДФ
для утворення 1 молекули АТФ. Таким чином, |
при окисненні 1 молекули ацетил-КоА |
||||
утворюється 12 молекул АТФ (11 + 1 = 12). |
|
|
|
||
|
|
|
|
||
|
Регуляція ЦТК |
||||
піруват |
АТФ, ацетилКоА , НАДН, |
||||
|
|||||
піруват- |
жирні кислоти |
|
|
|
|
дегідрогеназний |
АМФ, НSКоА, НАД+, Са2+ |
||||
комплекс |
|||||
ацетил -КоА |
|
|
|
||
|
АТФ, НАДН, сукциніл-КоА |
||||
|
АДФ |
|
|
|
|
цитрат |
цитрат |
|
Найголовнішим чинником |
|
|
синтаза |
|
регуляції циклу є співвідно - |
|
||
|
|
|
шення НАДН /НАД+. |
|
|
оксалоацетат |
ізоцитрат |
||||
ЦТК |
|
АТФ |
|||
малат |
ізоцитрат |
||||
|
|
|
|||
дегідрогеназа |
дегідрогеназа |
АДФ, Са2+ |
|||
НАДН |
|
|
|
|
|
малат |
α-кетоα-кетоглутарат |
||||
ФАДН2 |
глутарат - |
НАДН, сукциніл-КоА |
|||
|
дегідрогеназа |
Са2+ |
|||
|
|
||||
сукцинат |
сукциніл SКоА |
||||
дегідрогеназа |
|
|
|
|
|
|
інгібування |
ГТФ |
активація |
|
|
50 |
|
