
4.4 Реакции декарбоксилирования.
Реакции декарбоксилирования карбоновых кислот – энергетически выгодный процесс, т.к. в результате образуется устойчивая молекула СО2. Декарбоксилирование характерно для кислот у которых в α-положении имеется электроноакцепторный заместитель. Легче всего декарбоксилируются двухосновные кислоты.
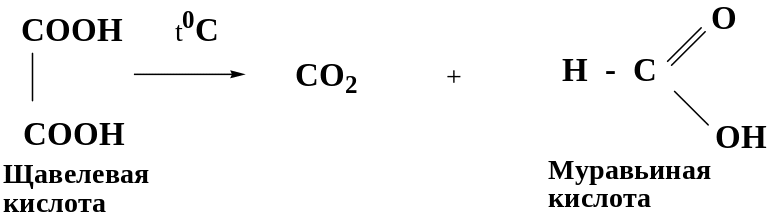
Щавелевая и малоновая кислоты легко при нагревании декарбоксилируются, а при нагревании янтарной и глутаровой кислот происходит образование циклических ангидридов, что обусловлено образованием пяти- или шестичленных гетероциклов, имеющих устойчивые конформации "полукресла” и “кресла”
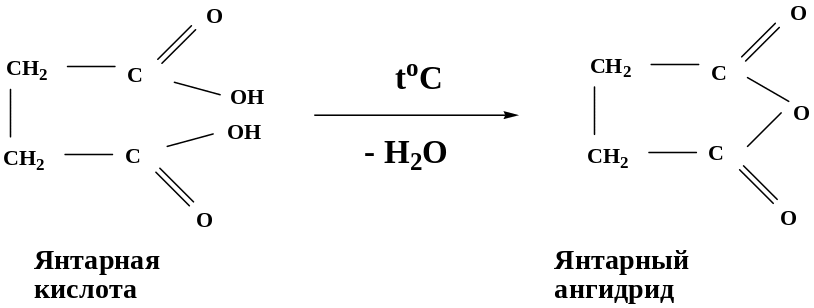
В биологических системах реакции декарбоксилирования протекают с участием ферментов – декарбоксилаз.
Декарбоксилирование аминокислот приводит к образованию биогенных аминов.
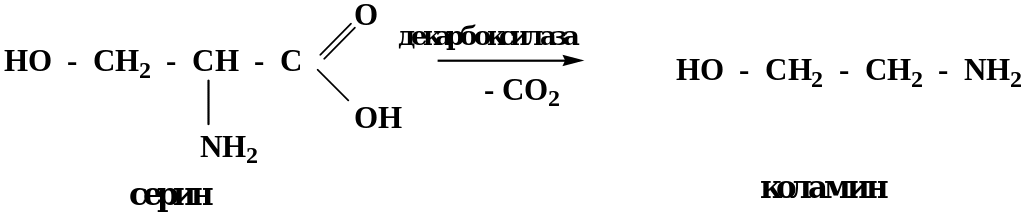
5. ПРАКТИЧЕСКАЯ ЧАСТЬ:
Лабораторная работа № 1
ОПЫТ 1. Получение и гидролиз железа (III) ацетата
В пробирку поместить по 3 капли уксусной кислоты и воды. Испытать реакцию на лакмус. К раствору прибавить по 2-3 капли 10% раствора NaОН до полной нейтрализации. После этого добавить 2-3 к. 1% раствора FeCl3. Появится желто-красное окрашивание. Подогреть раствор до кипения. Выделяется красно-бурый осадок нерастворимого в воде диацетата железа гидроксида.
ФОРМА ОТЧЕТА:
1. Написать краткую методику проведения опыта.
2. Написать схему диссоциации уксусной кислоты.
3. Написать схему реакции образования железа (III) ацетата.
4. Написать схему реакции гидролиза железа ацетата.
ОПЫТ 2. Образование нерастворимых солей высших жирных кислот
А. В пробирку с раствором мыла добавить несколько капель 10% раствора бария хлорида. Выпадает белый осадок нерастворимой соли.
В. Гидролиз мыла.
В пробирку с раствором мыла добавить 4 капли спиртового раствора фенолфталеина. Объяснить появление розовой окраски.
ФОРМА ОТЧЕТА:
1. Методика проведения опытов А и В
2. Уравнение реакций образования нерастворимых солей высших жирных кислот (натрия стеаратов) и уравнение гидролиза натрия стеарата.
3. Почему растворы мыл имеют щелочную реакцию?
ОПЫТ 3. Омыление жира
К 0,5 мл подсолнечного масла прилить 0,5 мл 30% раствора натрия гидроксида и смесь осторожно кипятить 5-6 минут. Омыление считают законченным, если взятая стеклянной палочкой капля жидкости полностью растворится в дистиллированной воде с образованием пены.
ФОРМА ОТЧЕТА:
1. Кратко описать методику проведения опыта.
2. Привести уравнения реакции омыления растительного жира на примере олеиновой кислоты. Назвать продукты.
3. К какому типу реакций относится реакция омыления жира?
ОПЫТ 4.
А. Окисление олеиновой кислоты калия перманганатом
В пробирку поместить 2 капли олеиновой кислоты, 2 капли 1% раствора калия перманганата и 1 каплю 5% раствора натрия карбоната. При встряхивании розовая окраска исчезает, что указывает на окисление олеиновой кислоты по месту двойной связи.
В. Присоединение брома к олеиновой кислоте
В пробирку внести 0,5 мл бромной воды, добавить 3-4 капли олеиновой кислоты и энергично взболтать. Объяснить причину обесцвечивания бромной воды.
ФОРМА ОТЧЕТА:
1. Кратко описать методику опыта.
2. Привести схему описания реакций. Назвать продукты.
3. Объясните возможность взаимодействия олеиновой кислоты с KMnO4 и Вr2.
ОПЫТ 5. Получение этилацетата
В сухую пробирку поместите порошок безводного натрия ацетата (высота около 2 мм) и 0,5 мл этилового спирта. К полученной смеси добавьте 2-5 капель концентрированной серной кислоты (в вытяжном шкафу) и осторожно немного нагрейте над пламенем спиртовки (следите за тем, чтобы смесь не выплеснулась). Через несколько секунд появляется приятный освежающий запах этилацетата. Реакция используется для открытия этилового спирта.
ФОРМА ОТЧЕТА:
1. Кратко описать методику опыта.
2. Привести схему описания реакции, механизм реакции.
3. Объяснить роль концентрированной серной кислоты в реакции этерификации.
6. вопросы ДЛЯ САМОконтроля знаний:
1) Приведите электронное строение карбоксильной группы и карбоксилат-аниона. Покажите влияние электронодонорных и электроакцепторных заместителей в радикале на изменение кислотности на примере следующих кислот: щавелевой, уксусной, моно-, ди- и трихлоруксусных кислот.
2) Объясните повышенную активность атома водорода при углеродном атоме (СН-кислотность) в карбоновых кислотах. Напишите реакцию галогенирования пропионовой и масляной кислоты.
3) Опишите механизм реакции нуклеофильного замещения (SN) на примере реакции этерификации изопропилового спирта и валериановой кислоты.
4) Напишите уравнение реакций получения ангидридов янтарной и малеиновой кислот, хлорангидрида пропионовой кислоты, Nа-соли стеариновой кислоты.
5) Напишите схему реакции декарбоксилирования щавелевой и малоновой кислот.
6) Напишите уравнение реакции гидрирования олеиновой кислоты.
