
- •Методическая разработка
- •I курса медико-диагностического факультета в I семестре
- •Запись экспериментальных данных
- •Запись экспериментальных данных
- •Масса воды m2
- •6.1 Коллигативные свойства растворов электролитов и неэлектролитов
- •6.2 Понятие о гипо-, гипер- и изотонических растворах. Их применение в медицине
Министерство здравоохранения Республики Беларусь
Учреждение образования
«Гомельский государственный медицинский университет»
Кафедра общей и биоорганической химии
Обсуждено на заседании кафедры ___________________
Протокол №_____________________________________
Методическая разработка
для проведения занятия со студентами
I курса медико-диагностического факультета в I семестре
по общей и биоорганической химии
Тема № 6: Коллигативные свойства растворов
Время: 2,5 часа
1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ:
Сформировать представления о коллигативных свойствах растворов электролитов и неэлектролитов.
МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ:
Изучение коллигативных свойств растворов веществ позволяет сформировать представление о процессах массопереноса в организме человека, а также о свойствах растворов, применяемых в медицине.
ТРЕБОВАНИЯ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ:
а) понятие о растворах;
б) способы выражения состава растворов;
в) ТЭД, теории слабых и сильных электролитов.
В результате проведения занятия студент должен:
1) знать:
Законы, описывающие коллигативные свойства растворов электролитов и неэлектролитов.
2) уметь:
решать расчетные задачи на определение коллигативных свойств растворов различных веществ;
определять молярные массы неэлектролитов криоскопическим методом;
определять изотонический коэффициент и кажущуюся степень диссоциации электролитов криоскопическим методом.
2. СВЯЗЬ СО СМЕЖНЫМИ ДИСЦИПЛИНАМИ:
Полученные знания, умения навыки потребуются студентам медико-диагностического факультета при анализе биологических объектов, при изучении аналитической химии, медицинской физики, фармакологии и биохимии.
3. КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ:
3.1 Коллигативные свойства растворов электролитов и неэлектролитов
а) понижение давления пара над раствором – 1 Закон Рауля;
б) криоскопический закон Рауля;
в) эбуллиоскопический закон Рауля;
г) осмос и осмотическое давление.
3.2 Понятие о гипо-, гипер- и изотонических растворах. Их применение в медицине
4. ПРАКТИЧЕСКАЯ ЧАСТЬ ЗАНЯТИЯ:
Лабораторная работа № 1
Определение молярной массы лекарственного вещества
(неэлектролита) криоскопическим методом
Оснащение занятия: кристаллизатор, стакан на 200-250 мл, мерные цилиндры на 25 мл и 50 мл, термометр с делениями на 0,1-0,2оС, мешалка, металлический штатив, охлаждающая смесь, раствор глюкозы.
Методика проведения опыта: Определение молярной массы вещества по понижению температуры замерзания его раствора по сравнению с чистым растворителем выполняется с помощью криоскопа. Схема упрощенного криоскопа представлена на рисунке.
Р


 ис.
Упрощенный криоскоп
ис.
Упрощенный криоскоп
1
 – кристаллизатор
– кристаллизатор
2 – стакан
3



 – мешалка
– мешалка
4

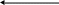 – термометр
– термометр
4
3








2


1

Приготовьте в кристаллизаторе (1) охлаждающую смесь из мелких кусочков льда и поваренной соли. Температура охлаждающей смеси не должна опускаться ниже –6оС. В химический стакан (2) на 50-100 мл налейте 25 мл раствора глюкозы с известной массовой долей (плотность раствора считать равной 1 г/мл). Поместите стакан с раствором глюкозы в охлаждающую смесь. Термометр с делениями 0,1-0,2о закрепите в лапке штатива и опустите в стакан так, чтобы шарик с ртутью был погружен в раствор.
Наблюдайте за понижением температуры раствора в химическом стакане, перемешивая раствор при помощи мешалки. Отметьте температуру появления первых кристаллов льда (t2), являющуюся температурой замерзания раствора в условиях данного опыта.
