
- •Декарбоксилирование аминокислот.
- •Азотистый обмен
- •Факторы определяющие состояние белкового обмена.
- •Различают 3 вида азотистого баланса:
- •Биологическая ценность белков.
- •Переваривание и всасивание
- •Обмен дикарбоновых аминокислот.
- •Виды нуклеиновых кислот
- •Структура нуклеопротеидов.
- •Виды мутаций:
- •Обмен нуклеотидов.
- •Механизм транскрипции днк
Переваривание и всасивание
Переваривание белков происходит в 3 этапа:
в желудке;
в тонком кишечнике;
в клетках слизистой оболочки тонкого кишечника.
Расщепление белков происходит при участии нескольких групп ферментов:
Экзопептидазы – катализирует разрыв концевой пептидной связи с образованием одной какой-либо аминокислоты.
Эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи.
К эндопептидазам относятся следующие ферменты: пепсин, гастрин, трипсин, химотрипсин, эластаза.
К экзопептидазам относятся: карбоксипептидазы, аминопептидазы, дипептидазы.
Экзопептизазы участвуют в переваривании белков в тонком кишечнике.
В результате расщепления образуются свободные аминокислоты, которые затем подвергаются всасыванию. Аминокислоты всасываются свободно с ионами натрия. Некоторые аминокислоты обладают способностью конкурентно тормозить всасывание других аминокислот:
Лизин тормозит всасывание аргинина. Это позволяет считать, что существует общая переносящая система.
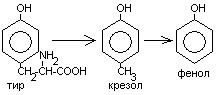
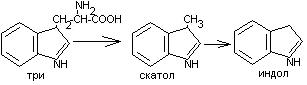
Часть аминокислот в кишечнике под действием микрофлоры подвергается гниению. В результате гниения аминокислот в кишечнике образуются ядовитые продукты распада – фенол, индол, крезол, скатол, сероводород. Распад цистеина, цистина, метионина приводит к образованию сероводорода, метилмеркаптана. Диаминокислоты – арнитин и лизин подвергаются декарбоксилированию с образованием путресцина и кадаверина.
Микробные ферменты кишечника превращают тирозин крезол фенол
триптофан скатол индол.
После всасывания эти продукты через воротную вену попадают в печень, где обезвреживаются путем связывания с серной или глюкуроновой кислотами с образованием парных кислот, которые выделяются с мочей.

Аминокислоты как лекараственные препараты.
Препараты гидролизатов белков – используются для перентерального питания.
К ним относятся гидролизин, гидролизат казеина, аминопептид, церебролизин, аминокровин, фиброносол.
Применяют после операций на ЖКТ, у больных с нарушениями переваривания белков и аминокислот, при тяжелых ожегах.
Препараты отдельных аминокислот.
Метион – липотропный фактор, а также для лечения белковой недостаточности при хронических заболеваниях.
Цистеин – при нарушениях обмена серосодержащих белков (хрусталик, роговица глаза, коллаген), при отравлениях солями тяжелых Ме, которые связываются аминокислотами.
Глутаминовая кислота и аспарагиновая кислота (калиевые и магниевые соли – препарат панангин, аспаркам) используются для обезвреживания аммиака.
Пути обезвреживания аммиака.
Уровень аммиака в норме в крови не превышает 60 мкМоль/литр. Для кроликов концентрация аммиака 3 мМоль/литр является летальной.
В организме существует 4 пути обезвреживания аммиака.
О
 бразование
глутамина – процесс идев в мозге,
сетчатке, почках, печени и мышцах.
бразование
глутамина – процесс идев в мозге,
сетчатке, почках, печени и мышцах.
НООС-СН-СН2-СН2-СООН НООС-СН-(СН2)2-СONH2
| |
NH2 NH2
Глутамин выделяется с мочой.
Восстановительное аминирование -кетоглутаровой кислоты
-кетоглутарат+NH3 + НАДН глутамат + НАД+
Эта реакция обратная окислительному дезаминированию глутяминовой кислоты. Дальше глутамат связывает еще одну молекулу NH3 и дают глутамин. Глу+NH3 Глн.
Глутамин используется почками как резервный источник аммиака, необходимый для нейтрализации кислых продуктов обмена при ацидозе.
Образование аммонийных солей.
Аммиак в почках акцептирует протон кислоты, образуя аммонийную соль. Одновременно этот процесс обеспечивает сбережение организмом ионов Na+, которые в отсутствие ионов аммония выводились бы с анионами кислот.
NH3+Н+Cl- NH4Cl
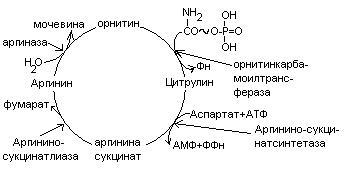
Биосинтез мочевины.
Мочевина – главный конечный продукт обмена азота в организме. С мочой за сутки выводится 25-30 г мочевины. Синтез мочевины идет в печени. Превращение аммиака в мочевину осуществляется в форме цикла. Цикл мочевины открыли Ганс Кребс и Курт Хенселайт (1932г).
Пернвая аминогруппа, поступающая в цикл мочевины, получается в виде свободного аммиака при окислительном дезаминировании глутамата в митохондриях клеток печени. Эта рекция катализируется глутаматдегидрогеназой, для действия которой требуется НАД+
Глутамат+НАД++Н2О
-кетоглутарат
+
![]() +НАДН+Н+.
+НАДН+Н+.
Аммиак соединяется с двуокисью углерода с образованием карбомоилфосфата. Реакция требует затраты АТФ. Катализирует эту реакцию карбомоилфосфатсинтетаза. На следующей стадии карбомоилфосфат взаимодействует с орнитином с образованием цитрулина. Образовавшийся цитрулин переходит из митохондрий в цитозоль клеток печени. Цитрулин взаимодействует с аспартатом в присутствии АТФ с образованием аргининсукцината. Эта реакция катализируется аргининсукцинатсинтетазой. На следующей стадии аргининсукцинат расщепляется с образованием аргинина и фумарата. Фумарат возвращается в пул промежуточных продуктов цикла лимонной кислоты. На последней стадии аргинин под действием аргиназы расщепляется на мочевину и орнитин.
Регенерированный орнитин вновь поступает в митохондрии.
Мочевина из клеток печени поступает в кровь и через почки выводится с мочой.
Повышение концентрации аммиака в крови может вызвать повторяющуюся рвоту, возбуждение, припадки с потерей сознания (печеночная кома) и судорогами. При хронической врожденной гипераммониемии наблюдается отставание умственного развития. Наиболее частая причина гипераммониемии – нарушение орнитинового цикла. В орнитиновом цикле участвует 5 ферментов и имеет место 5 типов наследственных болезней. Люди с такими дефектами не переносят пищи, богатой белком. Детей с таким нарушением лечат введением -кетоаналогов аминокислот. -кетоаналоги незаменимых аминокислот могут под действием трансаминаз присоединять аминогруппы от имеющихся заменимых аминокислот. Это предотвращает возможность попадания аммиака в кровь.
Почему высокое содержание NH4+ токсично? Ион аммония сдвигает равновесие реакции, катализируемой глутаматдегидрогеназой, в сторону образования глутамата, а это приводит к истощению -кетоглутарата. Истощение -оксоглутамата, промежуточного продукта ЦТК, приводит к уменьшению скорости образования АТФ.
-оксоглутарат
![]() глутамат
глутамин
глутамат
глутамин
глутаматдегидрогеназа глутаминсинтетаза
Энергетическая цена синтеза мочевины
На синтез одной молекулы мочевины расходуется 4 высокоэнергетические фосфатные группы. Две молекулы АТФ требуются для образования аргининосукцината. Но в последней реакции АТФ подвергается пирофосфат, который гидролизуется с образованием 2 молекул ортофосфата. Поэтому на синтез мочевины расходуется 4 молекулы АТФ.
Синтез заменимых аминокислот
Аминирование
СООН COOH
| НАДФН2+NH4+ НАДФ |
(
 CH2)2
(CH2)2
про
CH2)2
(CH2)2
про
| | глн
C=O CHNH2
| |
COOH COOH
Переаминирование
Глу + пир ала + -КГ
Глу + ЩУК асп + -КГ
![]()
асн
Глю сер гли
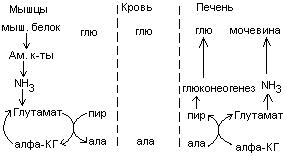
Токсическое действие аммиака.
+
-КГ
Глу![]() Глн
Глн
![]()
ЦТК![]() ЦТК
АТФ
в мозге
Кома
ЦТК
АТФ
в мозге
Кома
Способ лечения:
Перевод на малобелковую пищу
Замена заменимых аминокислот на кетокислоты (незам)
Гепатоцит
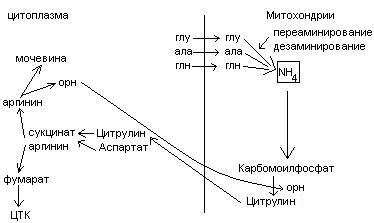
Индивидуальные пути обмена аминокислот.
Обмен глицина и серина.
Гли и сер относятся к заменимым, глюкопластичным аминокислотам.
Глицин, много содержится в белках, не имеет радикала, оптически неактивна, заменимая, глюкогенная NН2-СН2-СООН
Используется для синтеза креатина в почках
Почки
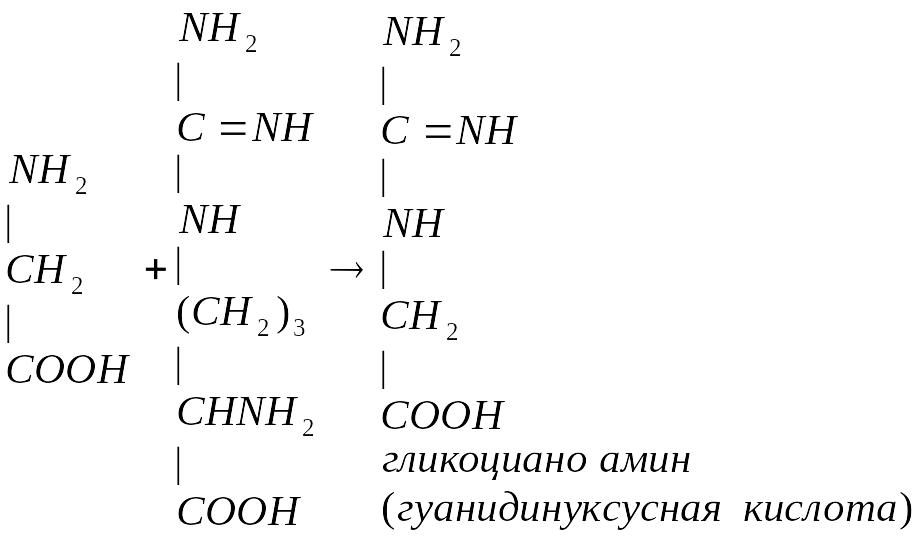
![]() Печень
Печень
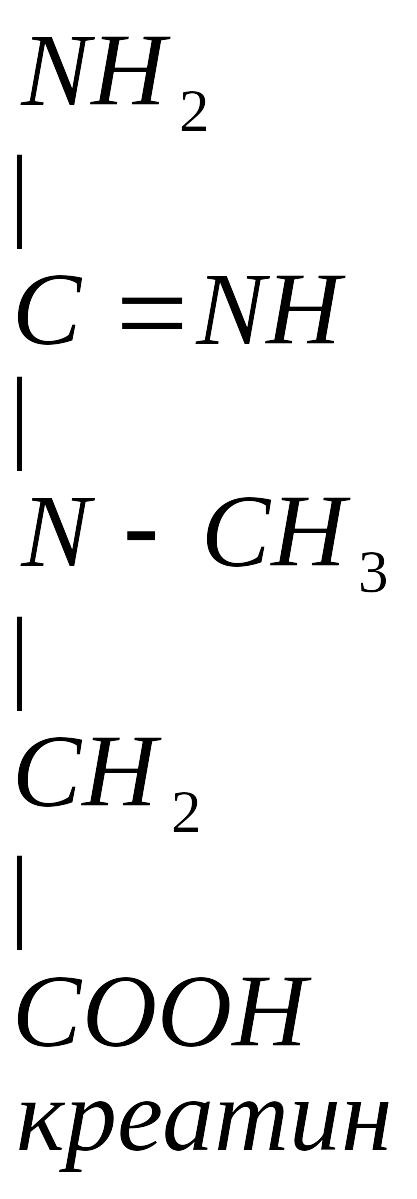
Мышцы требуют Е (кратковременная интенсивная работа). Должен быть запас Е-креатинфосфат.
![]()
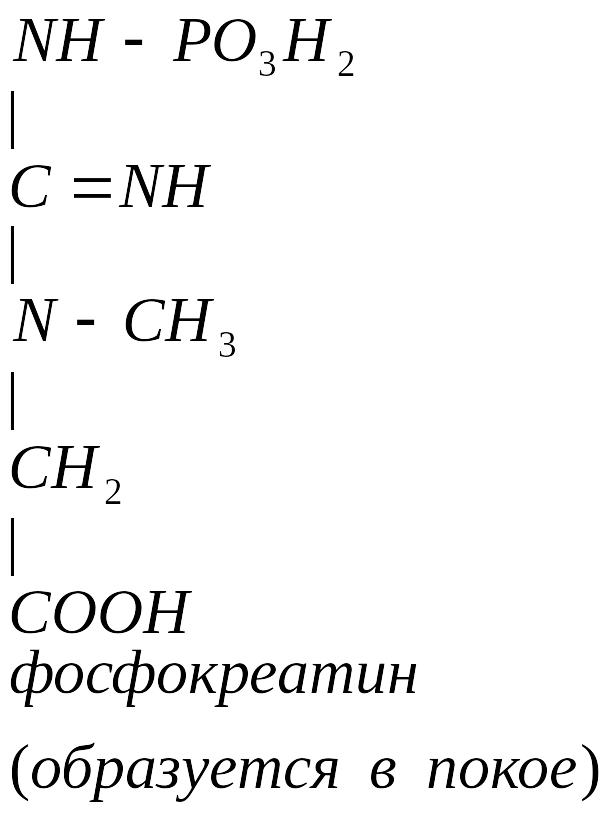
Может образовываться в других клетках. Это средство транспорта Е внутри клетки.
Фосфокреатин используется мышцами для кратковременной работы.
Продукт распада креатина креатин
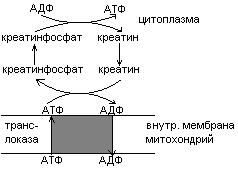
Креатинфосфат легко проходит в цитоплазму, он менее полярен, чем АТФ. Креатинфосфат отдает Фн на АДФ, а креатин возвращается в митохондрии. Такая транспортная функция креатинфосфата характерна для всех клеток.
Образование
 -аминолевулиновой
кислоты.
-аминолевулиновой
кислоты.Синтез пуриновых оснований. Глицин является остовом – это скелет.

Синтез вторичных желчных кислот. Желчные кислоты участвуют в переваривании жиров, холестеридов. Желчные кислоты активируются глицином (холевая – гликохолевая).
Глицин – нейромедиаторная АМК – тормозной медиатор нервной системы (30 минут). Глицин принимает участие в синтезе белков, пуриновых нуклеотидов, гема, парных желчных кислот, кератина, глутатиона.
Г |
Сер |
Т |
|
|
Г |
М |
Гли |
Л |
Гиппуровая кислота |
|
Гем |
Креатин |
Тре |
Пурины (ДНК, РНК) |
|
|
Желчные кислоты |
Глицин участвует в образовании гема:
СООН СН2-NH2 HSKoA COOH
| | B6 |
| B6 |
С Н2 + COOH CH2 + CO2
| ![]() -аминолевули-
|
-аминолевули-
|
СН2 натсинтаза CH2
| |
COSKoA C=O
|
CH2-NH2
-аминолевулиновая кислота
В качестве кофермента -аминолевулинансинтаза содержит витамин В6. -аминолевулинсинтаза – аллостерический, ключевой фермент синтеза гема. Ингибируется активность фермента по принципу обратной отрицательной связи – гемом.
Глицин принимает участие в синтезе креатина. Креатин обеспечивает работающую мышцу АТФ. Синтез креатина идет в почках и печени. В почках образуется гуанидинуксусная кислота:
NH2 NH2 NH2 NH2
| | | |
C=NH + CH2 (CH2)3 + C=NH
| | | |
NH COOH CH-NH2 NH
| глицин | |
(CH2)3 COOH CH2
| орнитин |
CHNH2 COOH
| гуанидинуксусная
COOH кислота
Аргинин
Гуанидинацетат с кровотоком поступает в печень, где в результате реакции трансметилирования дает креатин:
NH2 NH2 NH~PO3H2
| | |
C =NH
CH3
C=NH
АТФ
C=NH
=NH
CH3
C=NH
АТФ
C=NH
 |
| |
|
| |
NH N-CH3 N-CH3
| | |
CH2 CH2 CH2
| | |
COOH COOH COOH
Креатин Креатинфосфат
Источником метильного радикала является метионин.
Серин – заменимая аминокислота, углеродная часть которой образуется из глюкозы:
Г
 лю
лю
![]() 3-ФГК
3-ФГК
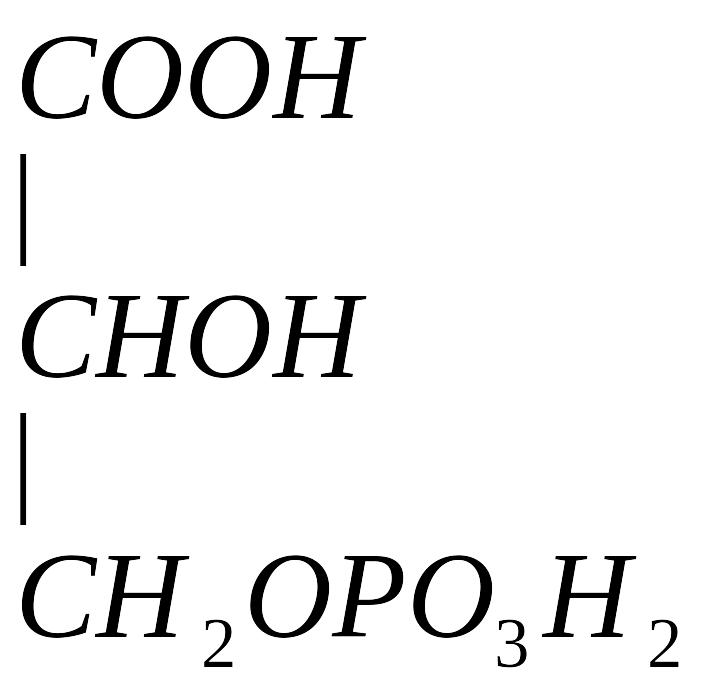 НАД
НАДН
НАД
НАДН
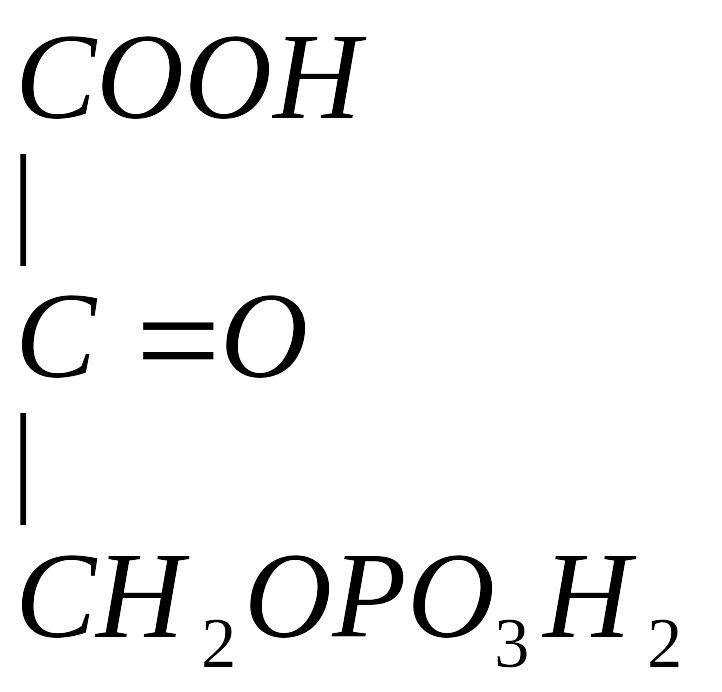
г


 лутамат
-кетоглутарат
лутамат
-кетоглутарат
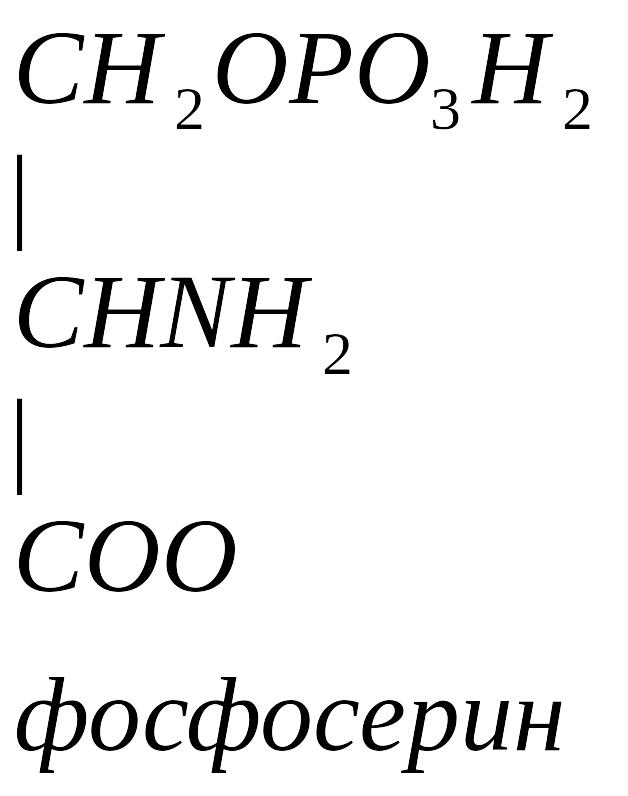
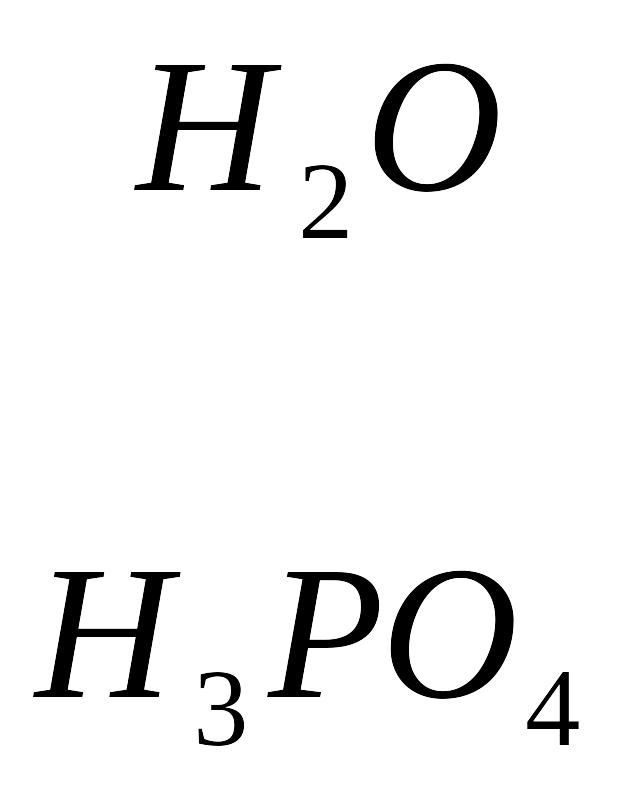

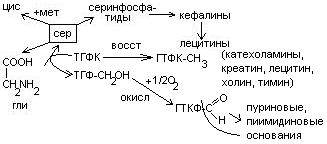
Серин – содержит ОН–группу, заменимая, глюкогенная. Является источником одноуглеродных фрагментов, которые идут на синтез БАВ (гормоны, медиаторы).
Серин является донатором одноуглеродных радикалов: метила, гидроксиметилена, формила.


Нарушения обмена ДОФА-амина
Паркинсонизм – мышечная дрожь, ригидность мышц (дегенерация ДОФА-амин синтезирующих нейронов). Можно моделировать паркинсонизм с помощью амфитамина
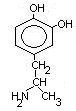
Лечат с помощью ДОФА (предшественник), легко проникает через мембраны.
Шизофрения – избыток накопления ДОФА-амина.
Обмен цистеина и метионина.
В молекулах белка обнаружены 3 серосодержащие аминокислоты: метионин, цистеин, цистин.
Цистеин в организме синтезируется из метионина.
Функции цистеина:
Цистеин участвует в образовании цистина:
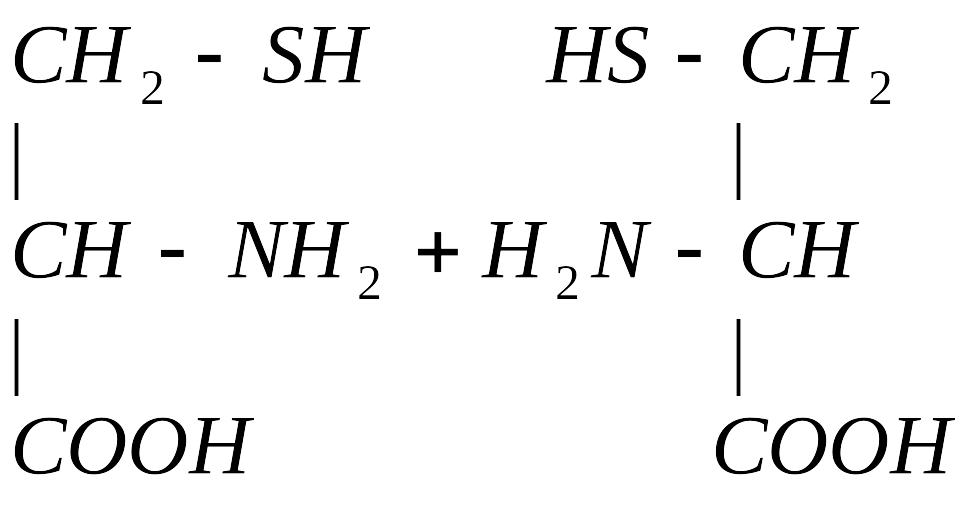


При образовании цистина возникает дисульфидная связь S-S между двумя полипептидными цепями, что способствует стабилизации третичной структуры белка.
Цистеин входит в состав трипептида глутатиона–Г–SH. Глутатион обеспечивает сохранение ферментов в активной форме. Глутатион участвует в ингибировании белков. Например, инсулина.
Цистеин превращается в таурин:
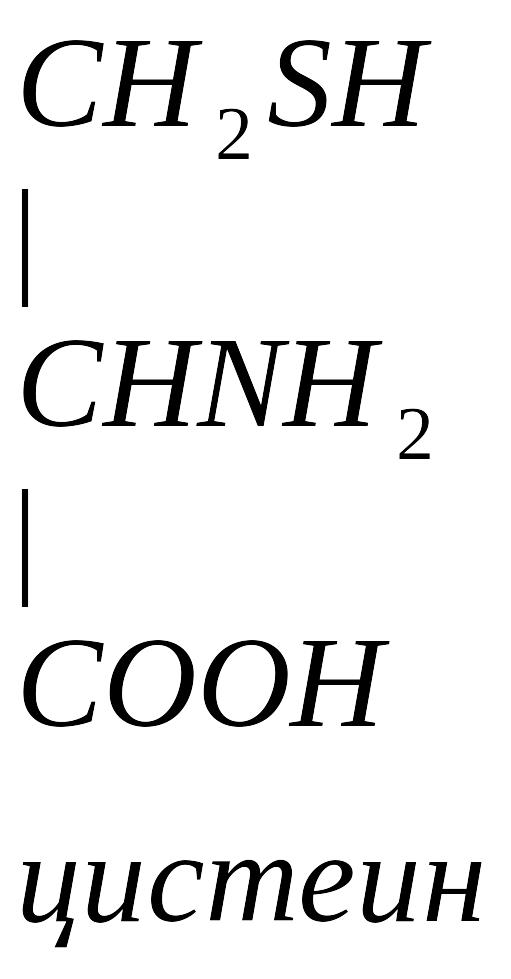


![]()
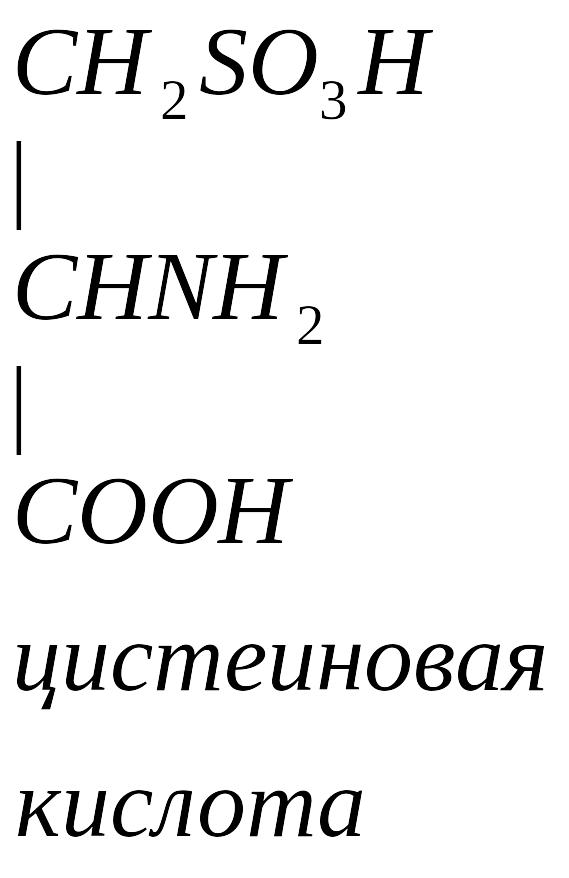
 СО2 СО2
СО2 СО2
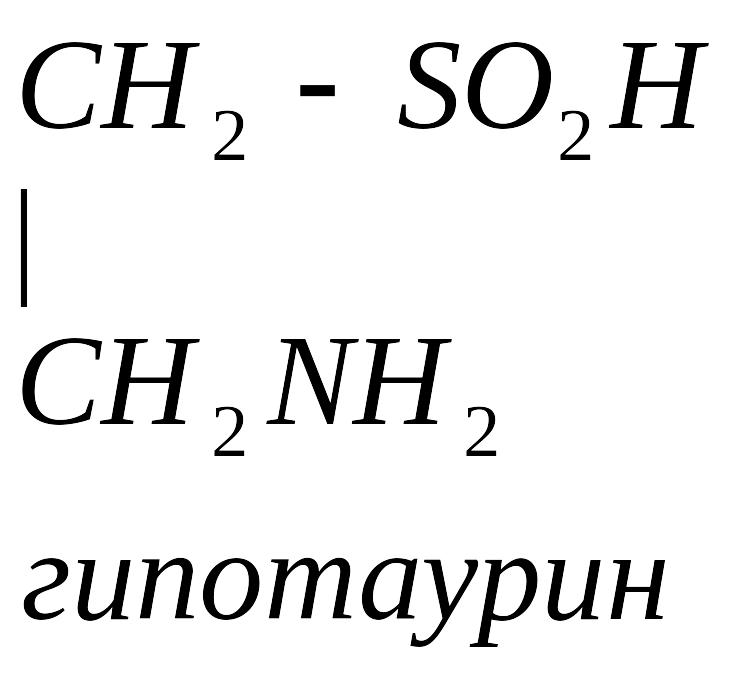
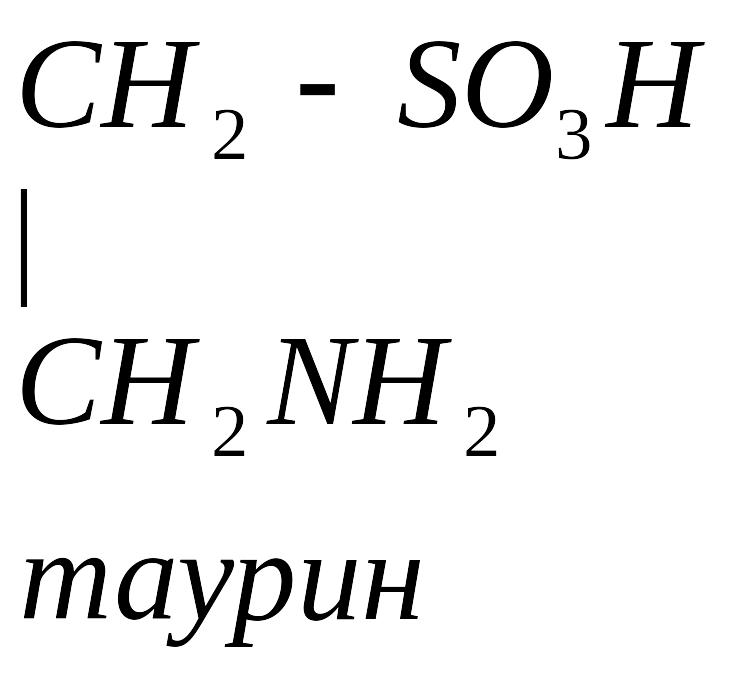
Таурин используется для синтеза парных желчных кислот.
Цистеин входит в состав активных центров ферментов.
Метионин – незаменимая аминокислота.
Функции метионина:
Метионин является источником одноуглеродного радикала – метила, который используется в реакциях трансметилирования. Непосредственным источником метильных групп является производное метионина – S-аденозилметионин.
Метионин участвует в синтезе креатина. Синтез креатина происходит в печени и почках. В почках образуется гуанидинацетат из аргинина и глицина:
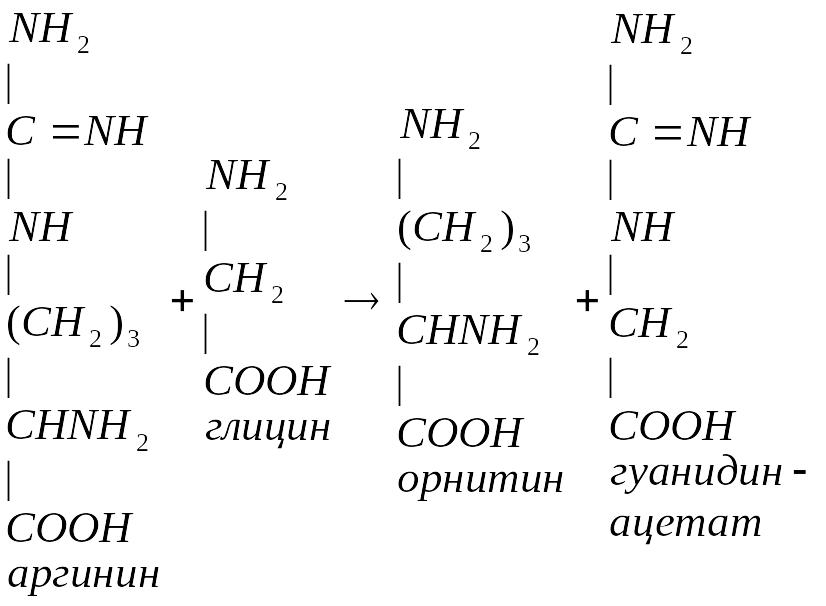
В печени гуанидинацетат взаимодействует с S-аденозилметионином и образуется креатин:
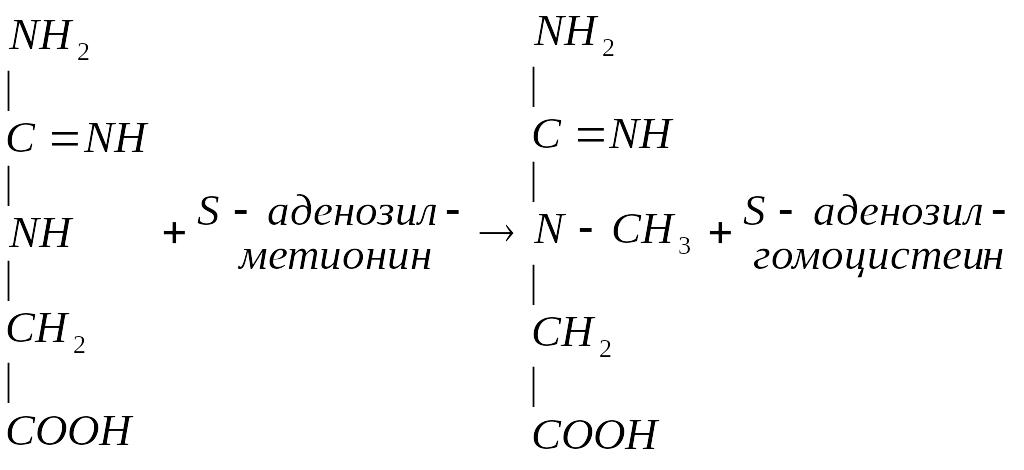
Метионин участвует в реакциях трансметилирования в синтезе: адреналина, мелатонина, азотистых оснований.
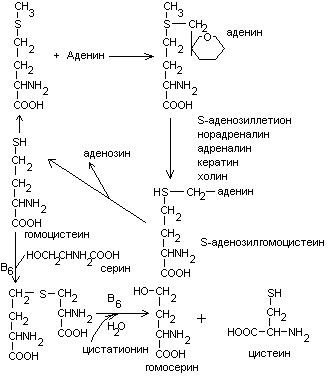
В результате реакции трансметилирования образуется гомоцистеин.
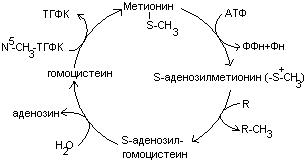
4. Гомоцистеин превращается в цистеин:
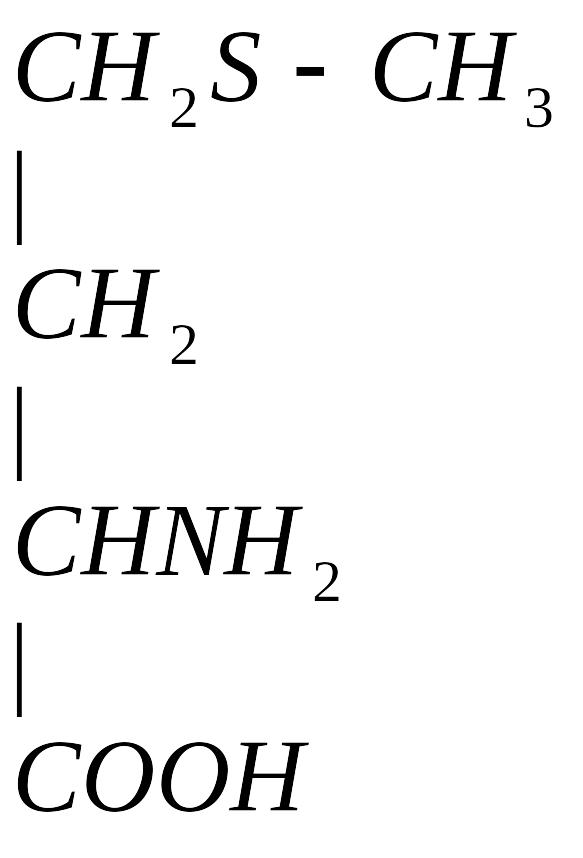

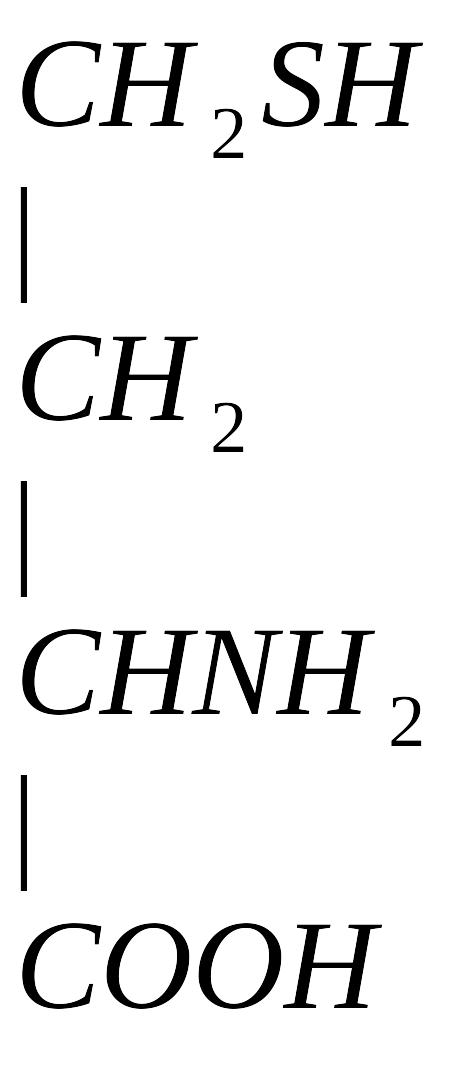 +
+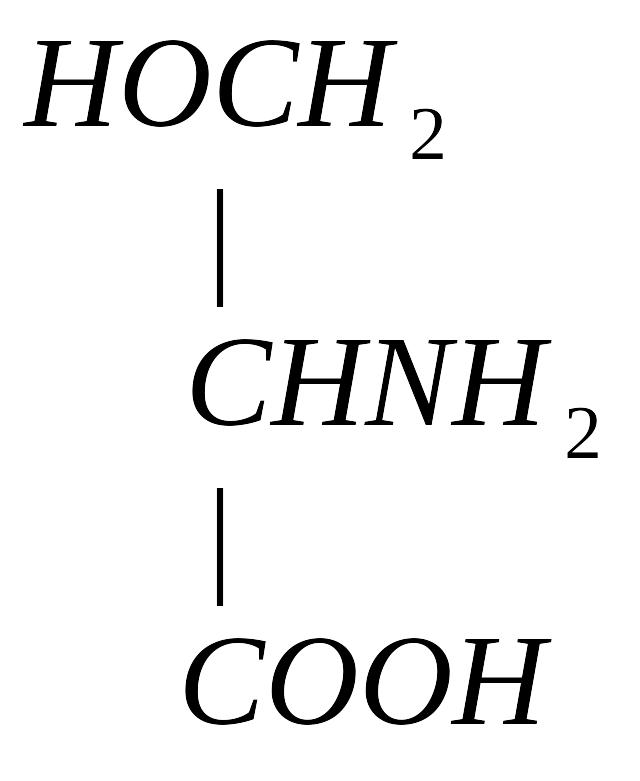

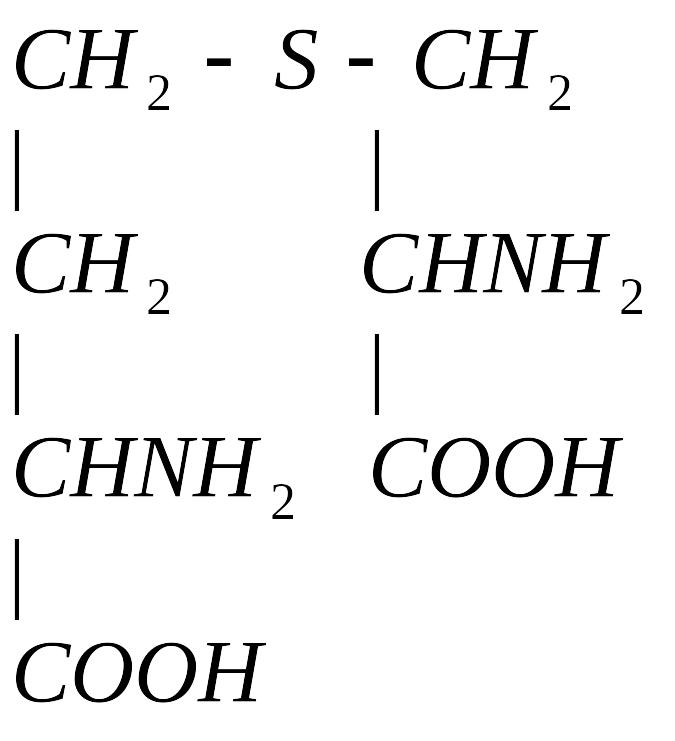
![]()
мет гомоцистеин серин цистатионин
![]()
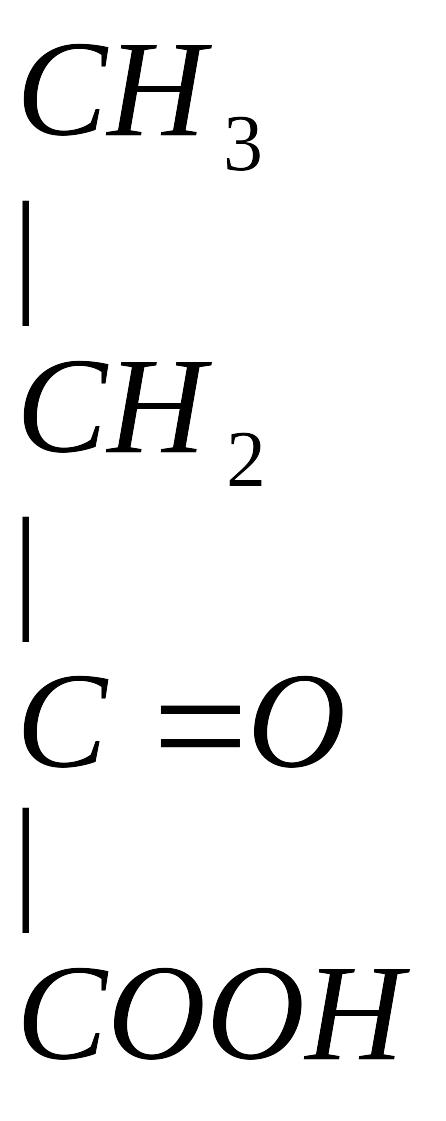 +
NH3
+
+
NH3
+
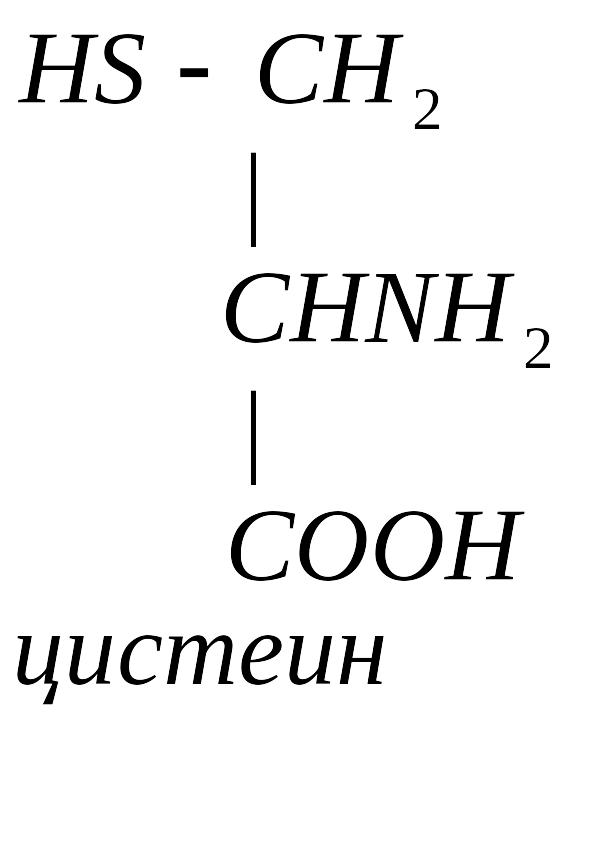
В
качестве кофермента цистатионин-![]() -синтаза
и цистатионин-
-лиаза
содержат пиридоксальфосфат (В6).
-синтаза
и цистатионин-
-лиаза
содержат пиридоксальфосфат (В6).
Гомоцистеин может превращаться в метионин путем метилирования.
Гомоцистеин может превращаться в гомоцистин. Накопление гомоцистина в тканях и крови – характерный симптом наследственной недостаточности ферментов, а также признак недостаточности витаминов В6 и В12. Гомоцистин накапливается, если нарушается превращение гомоцистеина в метионин и цистеин.
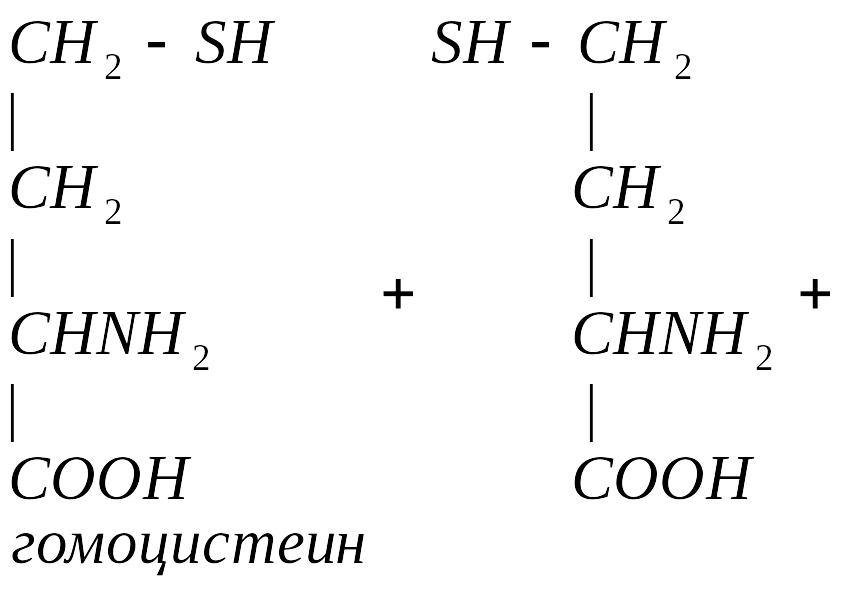
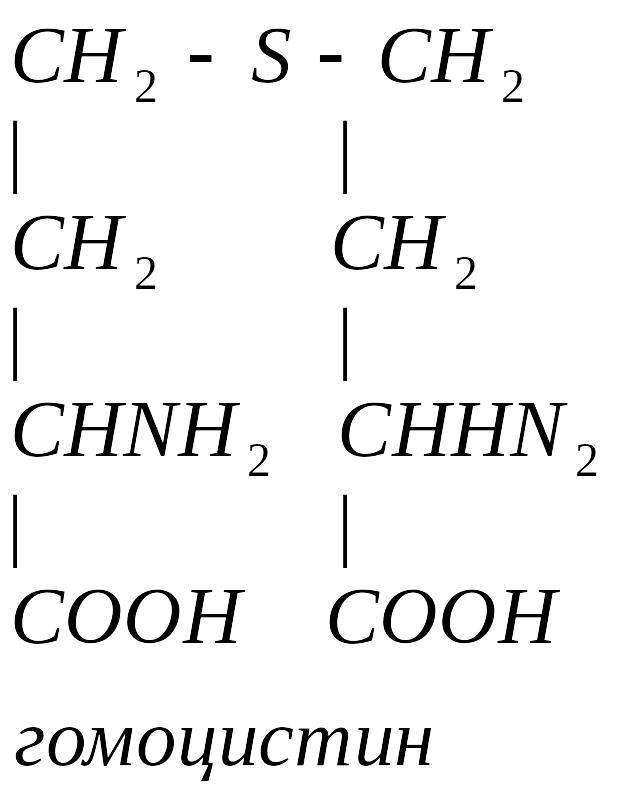
Гомоцистинурия – высокая концентрация гомоцистина и меионина. Нарушение умственного развития и скелета.
Цистинурия- выделение цистина с мочой: цистиновые камни в мочевых путях.
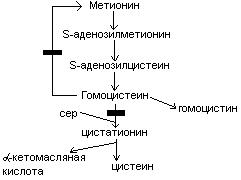
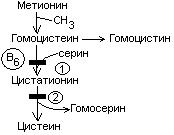
выделяют 2 причины образования блоков:
Наследственная недостаточность ферментов, участвующих в обмене.
Недостаточность (гиповитаминоз) В6, В12, фолиевой кислоты.
При блоке 1 развивается гомоцистинурия.
Биохимически накапливается мет и гомоцистин, т.к. гомоцистеин не превращается в цистатионин. Гомоцистин выделяется с мочой.
Клинически: нарушения со стороны соединительной ткани, сердечнососудистой системы, свертывающей системы, образование тромбов. Уродства черепа – башневидный череп, вывернутые глазные яблоки (подвывих хрусталика), умственная отсталость.
При блоке 2 развивается цистатионинурия.
Биохимически повышается концентрация цистатионина, уменьшается цистеина.
Цистинурия – в моче выделяется в 50 раз больше нормы цистина, лизина, аргинина, орнитина.
Причиной заболевания является нарушение реабсорбции цистина и нарушением всасывания остальных аминокислот.
Для людей с этой патологией характерно образование камней.

 лутатион
лутатион
 каневые
белки
каневые
белки люкоза
люкоза
 уравьиная
кислота
уравьиная
кислота

 ипиды
ипиды