
- •Российский университет дружбы народов
- •К практическим занятиям по биохимии
- •Авторский коллектив:
- •Предисловие как пользоваться этим учебным пособием?
- •Список сокращений и условных обозначений
- •Техника безопасности при работе в биохимической лаборатории
- •1. Общие требования безопасности
- •Классификация химических реактивов в биохимической лаборатории
- •2. Требования безопасности перед началом работ
- •3. Требования безопасности во время работы
- •4. Требование безопасности в аварийных ситуациях
- •5.Требование безопасности по окончании работы
- •Раздел 1: Аминокислоты и простые белки Введение
- •1.1 Проверка знаний по органической химии
- •1.2. Цветные реакции на белки и аминокислоты. Реакции осаждения и денатурации белков а. Цветные реакции на белки и аминокислоты
- •Б. Реакции осаждения и денатурации белков
- •1.3. Количественное определение белка биуретовым методом. Построение калибровочных кривых
- •1 .4. Диализ белков. Бумажная хроматография аминокислот
- •А. Диализ
- •1.5. Коллоквиум I по теме «Аминокислоты и простые белки»
- •Раздел 2: Сложные белки, нуклеиновые кислоты и ферменты Введение
- •2.1 Действие амилазы на крахмал. Влияние температуры на активность амилазы а. Действие амилазы на крахмал
- •Б. Изучение влияния температуры на скорость ферментативной реакции
- •2.2. Количественное определение активности щелочной фосфатазы в сыворотке крови с п-нитрофенилфосфатом
- •2.3. Коллоквиум II по теме: «Сложные белки, нуклеиновые кислоты и ферменты» Вопросы, для самостоятельной подготовки
- •Варианты письменной части коллоквиума
- •Варианты заданий на компьютерном тестировании
- •Правильные ответы
- •Раздел 3: Витамины, липиды, гормоны Введение
- •3.1. Количественное определение витаминов с и р.
- •3.3. Влияние гормонов на содержание глюкозы в крови
- •3.4. Коллоквиум III по теме «Витамины, липиды, гормоны»
- •Раздел 4: Метаболизм. Биоэнергетика клеток. Химия и обмен углеводов Введение
- •4.1. Специфичность действия ферментов распада углеводов: амилазы и сахаразы
- •4.2. Количественное определение глюкозы. Построение «сахарных кривых»
- •4.3. Определение активности сукцинатдегидрогеназы в мышцах. Количественное определение пирувата в моче
- •4.4 Коллоквиум IV по теме: «Метаболизм. Биоэнергетика клеток. Химия и обмен углеводов»
- •Правильные ответы
- •Раздел 5: Обмен липидов и его регуляция Введение
- •5.1. Кинетика действия липазы.
- •5.2. Количественное определение фосфатидилхолинов (лецитинов) по фосфору
- •I. Приготовление рабочего раствора сыворотки.
- •II. Определение концентрации фосфатидолхолинов по содержанию фосфора.
- •5.3. Количественное определение холестерина в сыворотке крови
- •5.4. Количественное определение малонового диальдегида
- •5.5. Коллоквиум по теме «Обмен липидов»
- •Раздел 6: Переваривание белков и обмен аминокислот
- •6.1. Количественный анализ желудочного сока. Определение свободной, связанной, общей соляной кислоты и общей кислотности желудочного сока.
- •6.2. Количественное определение аспартатаминотрансферазы и аланинаминотрансферазы в сыворотке крови
- •6.3. Доказательство проявления активности аланин-аминотрансферазы (АлАт) методом бумажной хроматографии
- •6.4. Экспресс-метод определения повышенного содержания фенилаланина в плазме крови
- •6.5. Количественное определение мочевины в моче ферментативным уреазным/фенол-гипохлоритным методом
- •6.6. Количественное определение креатинина в моче
- •6.7. Коллоквиум по теме: «Обмен простых белков» Вопросы, для самостоятельной подготовки
- •Варианты письменной части коллоквиума
- •Правильные ответы
- •Раздел 7: Обмен хромопротеинов и нуклеопротеинов. Биохимия крови и мочи. Биосинтез нуклеиновых кислот и белков. Введение
- •7.1. Определение общего билирубина в сыворотке крови
- •7.2. Количественное определение мочевой кислоты в моче
- •7.3. А. Определение активности -амилазы в моче
- •7.3. Б. Составные части мочи в норме и при патологии
- •7.4. Определение активности холинэстеразы в сыворотке крови
- •7.5. Определение активности лактатдегидрогеназы в сыворотке крови
- •7.6. Коллоквиум по теме: «Обмен хромопротеинов и нуклеопротеинов. Биохимия крови и мочи. Биосинтез нуклеиновых кислот и белка». Вопросы, для самостоятельной подготовки
- •Варианты письменной части коллоквиума
- •Правильные ответы
- •Раздел 8: Подготовка к экзамену
- •8.1. Основные вопросы, выносимые на обсуждение
- •8.2. Пример экзаменационного тестового задания по курсу биохимии
- •59. Найти соответствие между процессом и его графическим изображением
- •60. Цикл мочевинообразования установил
- •Ответы к экзаменационному тесту
- •Раздел 9: Приложения
- •9.1. Термины, различающиеся по смыслу, но сходные по написанию и звучанию
- •9.2. Стандартные биохимические наборы и реактивы, используемые в практикуме
- •9.3. Рекомендуемая литература
- •Содержание
- •Раздел 7: Обмен хромопротеинов и нуклеопротеинов. Биохимия крови и мочи. Биосинтез нуклеиновых кислот и белков. 126
- •Раздел 8: Подготовка к экзамену 148
- •Раздел 9: Приложения 161
1 .4. Диализ белков. Бумажная хроматография аминокислот
А. Диализ
Диализом называют процесс разделения высокомолекулярных веществ (например, белков) и низкомолекулярных (например, солей) с помощью полупроницаемых мембран.
Полупроницаемыми называют мембраны, диаметр пор которых позволяет проходить только низкомолекулярным соединениям. Примером естественных полупроницаемых мембран могут быть капсулы Боумена—Шумлянского почек. Широко используют искусственные полупроницаемые мембраны: целлофан, коллодий, на основе которых созданы диализаторы, в том числе «искусственная почка».
Метод диализа используют в научных лабораториях, в промышленности, в клинической практике.
Цель работы
Доказать, что низкомолекулярное соединение NaCl проходит через полупроницаемую мембрану, а высокомолекулярный белок не проходит и остается в диализируемом растворе.
Принцип метода
Метод основан на том, что низкомолекулярные вещества легко диффундируют через полупроницаемые мембраны в чистый растворитель, образуя диализат. Диффузия будет продолжаться, пока не произойдет выравнивание концентраций диффундируемого вещества между диализируемым раствором и диализатом. Процесс возобновится, если диализат заменить чистым растворителем или, если эта смена будет происходить постоянно (проточный диализ).
Выполнение работы
Подготовка диализатора: полупроницаемой мембраной могут быть диализные трубки или целлофановые диализные мешочки. Целлофан (квадрат 10х10 см) смачивают дистиллированной водой, делают в нем углубление и получают диализный мешочек.
Приготовление диализируемого раствора: в диализный мешочек помещают 20 капель разведенного яичного белка в 5 % растворе NaCl (белок одного яйца разводят в 300 мл 5% раствора NaCl) и перемешивают. Края целлофана зажимают между двумя стеклянными палочками, скрепленными между собой резиновыми кольцами.
Диализ. Мешочек с солевым раствором белка помещают в стакан с дистиллированной водой так, чтобы часть мешочка с раствором белка была полностью погружена в воду. Сразу же, на просвет можно заметить струйки солевого раствора, опускающиеся из мешочка на дно стакана, что обусловлено изменением рефракции воды.
Анализ результатов диализа. Через 60 мин после начала диализа проводят качественные пробы на белок (биуретовую реакцию) и на NaCl (с AgNO3) в соответствии с таблицей.
Реактивы |
Проба на белок в диализате |
Проба на белок в диализируемой жидкости |
Проба на ионы Cl- в диализате |
Диализат |
10 капель |
– |
10 капель |
Диализируемый раствор |
– |
10 капель |
– |
10 % NaOH |
5 капель |
5 капель |
– |
1 % CuSO4 |
1 капля |
1 капля |
– |
10 % HNO3 |
– |
– |
1 капля |
1 % AgNO3 |
– |
– |
1 капля |
Наблюдения |
|
|
|
Выводы
Б. Хроматография аминокислот
Хроматографический метод, разработанный русским ученым М.С. Цветом, является одним из относительно простых и быстрых методов разделения смеси веществ.
Существует несколько разновидностей метода в зависимости от принципа разделения смеси на составляющие компоненты (адсорбционная, ионообменная, аффинная хроматография).
Примером адсорбционной хроматографии является распределительная хроматография на бумаге, которая оказалась наиболее доступной для разделения аминокислот, отличающихся гидрофобностью радикалов а также для идентификации неизвестных аминокислот путём сравнения их подвижности со стандартными растворами известных аминокислот.
Цель работы
Провести разделение смеси двух неизвестных аминокислот1, рассчитать для каждой из них Rf (см. далее) и идентифицировать аминокислоты по сравнению с Rf стандартов (глутаминовая кислота и лейцин).
Принцип метода
Метод основан на различной растворимости отдельных аминокислот в двух частично смешивающихся жидкостях: в воде, которая удерживается фильтровальной бумагой и является неподвижной фазой растворителя, и в подвижной фазе органического растворителя (бутанол : уксусная кислота : вода, 5 : 1 : 4).
По мере продвижения растворителя по бумаге происходит многократное перераспределение аминокислот между подвижной и неподвижной фазами растворителей. Чем больше гидрофобность аминокислоты, тем быстрее она будет продвигаться по бумаге и наоборот. В соответствии с этим расстояния, которые аминокислоты пройдут с подвижной фазой растворителя по бумаге, будут различными.
Скорость передвижения каждой аминокислоты может быть выражена коэффициентом распределения (Rf). Коэффициентом распределения называют отношение расстояний (в мм) от места нанесения аминокислоты (старта) до середины ее пятна (величина а) к расстоянию от места старта до границы фронта растворителя (величина b). Чем выше гидрофобность аминокислотного радикала, тем ближе к единице будет величина Rf.
Коэффициент распределения для каждой аминокислоты постоянен при стандартных условиях проведения опыта (тип бумаги, температура, тип растворителя, влажность) и служит средством идентификации аминокислот по сравнению со стандартами.
Выполнение работы
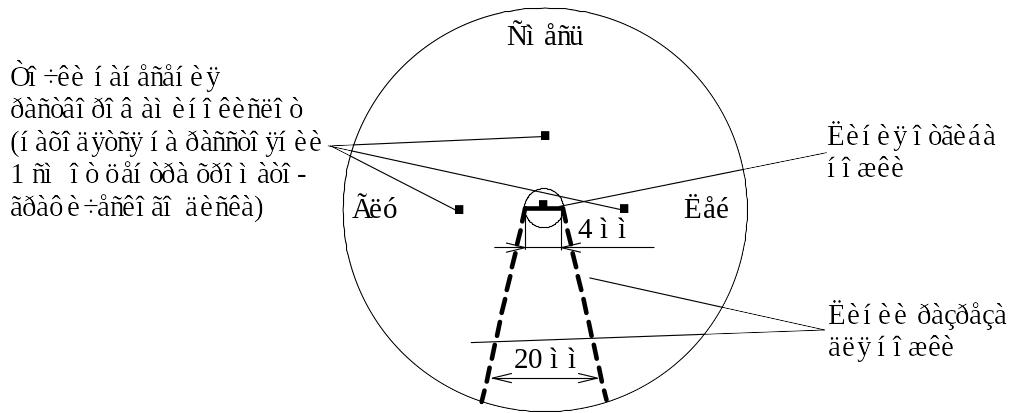
Диск хроматографической бумаги (d = 12 см) размечают карандашом (см. рисунок ниже).
В места, отмеченные точками, наносят по 2 мкл образцов стандартных растворов аминокислот (0,6% раствор глутаминовой кислоты и 0,5% раствор лейцина) и смесь неизвестных аминокислот. Высушивают бумажный диск с образцами на воздухе.
Разрезают хроматографический диск по линиям разреза, отгибают по линии сгиба получившуюся ножку и укорачивают ее до длины 3 см. Помещают диск в хроматографическую камеру (чашку Петри) так, чтобы ножка была погружена в органический растворитель.
Когда фронт растворителя пройдет 5 - 6 см, извлекают хроматограмму из камеры и тщательно обводят карандашом образовавшийся фронт растворителя.
Высушивают диск в сушильном шкафу при 60-80С.
Погружают диск в 0,5% раствор нингидрина в ацетоне и вновь высушивают до проявления пятен аминокислот1.
Оформление работы:
В рабочей тетради записать ход работы, рассчитать значение Rf для каждой аминокислоты, вклеить полученную хроматограмму или зарисовать её.
Выводы
Тестовые задания по теме: «Структура и свойства пептидов и белков»
1) Ответить на каждый вопрос однозначно: «да» или «нет»
Целостность четвертичной структуры белка важна для проявления его биологической активности.
Кератин не растворим в воде.
Все белки содержат однотипные домены.
Фолдинг белковых молекул начинается с быстрого формирования элементов вторичной структуры.
Природные пептиды могут обладать гормональной активностью.
Применим ли метод диализа для разделения белков с различной молекулярной массой?
Существуют ли белки, не содержащие β-складчатые слои?
Можно ли разделить белки методом бумажной хроматографии?
Вся ли полипептидная цепь белков полностью спирализована?
Содержится ли белок в моче здорового человека?
Участвуют ли водородные связи в образовании вторичной структуры белка?
Относятся ли гистоны к кислым белкам?
2) Выбрать один правильный ответ
Смесь различных белков невозможно разделить методом: ионнообменной хроматографии электрофореза высаливания диализа гель-фильтрации
|
Шапероны участвуют в образовании: первичной структуры белков первичной структуры нуклеиновых кислот третичной структуры белков третичной структуры нуклеиновых кислот вторичной структуры нуклеиновых кислот |
3) Найти соответствие
Характер радикала аминокислот |
АМК |
Гидрофильный Гидрофобный Амфифильный |
А. Лейцин Б. Глицин В. Валин Г. Серин Д. Глутамин |
