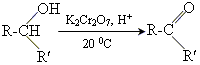Спирти.
Загальна характеристика Поширення у природі Спирти є досить поширеними сполуками у природі і виконують в живих організмах різноманітні функції. Ще більш поширеними сполуками є похідні спиртів, серед яких перш за все слід відзначити складні ефіри. Нижчі спирти та їх ефіри часто обумовлюють запах рослин і входять до складу так званих ефірних масел*. Вищі спирти та їх ефіри входять до складу жирів, бджолиного воску*, тощо. Класифікація • класифікація за кількістю гідроксогруп одноатомні спирти, наприклад: метанол, етанол багатоатомні спирти, наприклад: етиленгліколь, гліцерин • класифікація за будовою вуглеводневого радикалу насичені спирти, наприклад: метанол, етанол ненасичені спирти, наприклад: гексен-3-ол-1, гераніол* ароматичні спирти (феноли), наприклад: фенол, крезоли* Використання • хімічна промисловість • виробництво полімерів • харчова промисловість • фармацевтична промисловість • виготовлення розчинників |
Отримання і хімічні властивості одноатомних насичених спиртів Отримання Промислові методи отримання 1. Отримання метанолу • піроліз деревини • отримання із синтез-газу СО + 2Н2 → СН3ОН 2. Отримання етанолу • гідратація етилену СН2=СН2 + Н2О → СН3–СН2–ОН • бродіння глюкози С6Н12О6→ 2С2Н5ОН + 2СО2 Лабораторні методи 1. гідратація алкенів
2. гідроліз галогенпохідних вуглеводнів 2СH3–СH2–Br + Ag2O + H2O → 2СH3–CH2–OH + 2AgBr Хімічні властивості 1. кислотні властивості спиртів Спирти проявляють дуже слабкі кислотні властивості - реагують з лужними або лужноземельними металами з утворенням алкоголятів 2СH3CH2OH + 2Na 2СH3CH2ONa + H2 алкоголяти легко гідролізуються СH3CH2ONa + H2O СH3CH2OH + NaOH 2. реакції з галогеноводнями (HCl, HBr) R–OH + HCl R–Cl + H2O 3. реакції дегідратації • внутрішньомолекулярна дегідратація CH3-CH2-OH → CH2=CH2 + H2O • міжмолекулярна дегідратація 2CH3-CH2-OH → CH3-CH2-О-CH2-CH3 Обидві реакції протікають при нагріванні у присутності сульфатної кислоти і конкурують між собою. При температурі вище за 140 0С переважає реакція утворення алкену. 4. реакції окислення • первинні спирти окислюються найбільш легко - спочатку до альдегідів, а потім до карбонових кислот:
• вторинні спирти окислюються до кетонів
• третинні спирти стійкі до дії звичайних окислювачів • горіння спиртів С2H5ОH + 7/2O2 → 2СO2 + 3H2O |
Отримання і хімічні властивості етиленгліколю і гліцерину Отримання 1. Отримання етиленгліколю • отримання з етилену CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl Cl-CH2-CH2-Cl + H2O → OH-CH2-CH2-OH • отримання за реакцією Вагнера
2. Отримання гліцерину звичайно гліцерин отримують при лужному гідролізі жирів
Хімічні властивості Етиленгліколь вступає у всі реакції, що є характерними для одноатомних спиртів, але є і особливості пов'язані з наявністю двох гідроксогруп. 1. реакція з лужними металами дає два ряди гліколятів OH-CH2-CH2-OH + Na → OH-CH2-CH2-ONa + 1/2H2; OH-CH2-CH2-OH + 2Na → Na-CH2-CH2-ONa + H2 2. при взаємодії з галогеноводневими кислотами (HCl або HBr) легко заміщується лише одна гідроксогрупа OH-CH2-CH2-OH + HCl → Cl-CH2-CH2-OH + H2O 3. на відміну від одноатомних спиртів, характерною особливістю етиленгліколю є реакція взаємодії з гідроксидом Купруму, в результаті якої утворюється розчинний комплекс яскраво-синього забарвлення
Гліцерин за своїми властивостями більш подібний до етиленгліколю, ніж до одноатомних спиртів. Так, гліцерин дає три ряди гліцератів і три ряди похідних при взаємодії з галогеноводнями. Як і етиленгліколь, гліцерин при взаємодії з гідроксидом Купруму утворює з комплекс яскраво-синього забарвлення. 1. реакція гліцерину з гідроксидом Купруму(ІІ)
|