
Состояние электролита в растворе.
I.Олово в составе катиона основания и в составе аниона кислоты носит слабый характер, т. к. Кдисс.<10-2. Рассмотрим 2 реакции: а) гидролиз по катиону, где олово входит в состав катиона слабого основания, и б) гидролиз по аниону, где олово входит в состав аниона слабой кислоты.
а) Sn(OH)2+H2SO4=SnSO4+H2O
SnSO4(тв.)+aq![]() Sn2+*aq+(SO4)2-*aq
Sn2+*aq+(SO4)2-*aq
Ионное уравнение гидролиза по Iстадии:
 Sn+2+H2O
(SnOH)++H+
Sn+2+H2O
(SnOH)++H+


![]()
![]()
H++OH- Sn2++OH-




КIдисс.=3.1*10-8Кпосл.дисс.=4*10-10
Молекулярное уравнение гидролиза по Iстадии:
 2SnSO4+2H2O
(SnOH)2SO4+H2SO4
2SnSO4+2H2O
(SnOH)2SO4+H2SO4
Так как в результате гидролиза в растворе появляются свободные ионы H+, тоpH<7(кислая среда).
б) 2NaOH+H2SnO2=Na2SnO2+2H2O
Na2SnO2(тв.)+aq![]() 2Na+*aq+(SnO2)-2*aq
2Na+*aq+(SnO2)-2*aq
Ионное уравнение гидролиза по Iстадии:

 (SnO2)2-+H2O
(HSnO2)-+OH-
(SnO2)2-+H2O
(HSnO2)-+OH-

![]()
![]()

 H++OH-
H++(SnO2)2-
H++OH-
H++(SnO2)2-


КIдисс.=2*10-16Кпосл.дисс.=1.6*10-10
Молекулярное уравнение гидролиза по Iстадии:
N a2SnO2+H2O
NaHSnO2+NaOH
a2SnO2+H2O
NaHSnO2+NaOH
Так как в результате гидролиза в растворе появляются свободные ионы OH-,тоpH>7(щелочная среда).
II.РассчитаемpHсреды для солейSn(NO3)2иSnCl2сC, равной 0.9 г/л. обе соли образованы слабым основанием и сильной кислотой, следовательно гидролиз по катиону,pHдолжна быть <7. Формула для расчетаpH:
pH=-1/2lg![]()
Sn(OH)2+2HNO3=Sn(NO3)2+2H2O
Sn(OH)2– слабый электролит, Кдисс.=4*10-10
Mнитрата Sn(II)=119+(14+16*3)*2=243 г/моль
Cнитрата
Sn(II)=![]() =
=![]() =0.0037
моль/л
=0.0037
моль/л
pH=-1/2lg![]() =-1/2lg(0.000925*10-4)=3.5
=-1/2lg(0.000925*10-4)=3.5
Sn(OH)2+2HCl=SnCl2+2H2O
Sn(OH)2– слабый электролит, Кдисс.=4*10-10
Mхлорида Sn(II)=119+35.5*2=190 г/моль
Cхлорида
Sn(II)=![]() =
=![]() =0.0047
моль/л
=0.0047
моль/л
pH=-1/2lg![]() =-1/2lg(0.001175*10-4)=3.45
=-1/2lg(0.001175*10-4)=3.45
Гидролиз соли можно усилить, если
добавить воды(уменьшить концентрацию);
н
 агреть
раствор (при этом усиливается
эндотермическая реакция воды:H2OH++OH—57кДж,
следовательно увеличивается количество
ионовH+иOH-,
которые необходимы для осуществления
гидролиза соли);
агреть
раствор (при этом усиливается
эндотермическая реакция воды:H2OH++OH—57кДж,
следовательно увеличивается количество
ионовH+иOH-,
которые необходимы для осуществления
гидролиза соли);
И уменьшить, если
увеличить концентрацию растворенного вещества;
охладить раствор;
ввести в раствор один из продуктов гидролиза: подкислять раствор, если среда в результате реакции кислотная.
Для составления схем Пурбе для двух данных солей нужно рассчитать pHгидратообразования. Так как гидратообразование идет по катиону (соли образованы слабым основанием и сильной кислотой), то формулаpHтакая:
pH=14+1/z*lg
pHнитрата Sn(II)=14+1/2lg
 =14+1/2lg(378.38*10-27)=1.785
=14+1/2lg(378.38*10-27)=1.785
pHгидратообразования<pHгидролиза, следовательно, гидратообразование идет по прямой линии.
Схема Пурбе для соли Sn(NO3)2:

 pH
гидрато-
pH
гидрато-

 образованияpH гидролиза
образованияpH гидролиза



 0 1,785
3,5 7
0 1,785
3,5 7


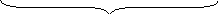


 Sn2+*aqсдвиг
гетерогенного
Sn2+*aqсдвиг
гетерогенного
 равновесия
равновесия
 гетерогенное
равновесие
гетерогенное
равновесие
 Sn2+aqSn(OH)2
Sn2+aqSn(OH)2
pHхлорида Sn(II)=14+1/2lg
 =14+1/2lg(297.87*10-27)=1.735
=14+1/2lg(297.87*10-27)=1.735
pHгидратообразования<pHгидролиза, следовательно, гидратообразование идет по прямой линии.
Схема Пурбе для соли SnCl2:

 pH
гидрато-
pH
гидрато-

 образованияpH гидролиза
образованияpH гидролиза



 0 1,735
3,45
7
0 1,735
3,45
7


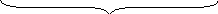

 Sn2+*aqсдвиг
гетерогенного
Sn2+*aqсдвиг
гетерогенного
 равновесия
равновесия
 гетерогенное
равновесие
гетерогенное
равновесие
 Sn2+aqSn(OH)2
Sn2+aqSn(OH)2
