
- •Образцы тестов.
- •Вариант 2 Часть а
- •Электродный потенциал е - это скачок потенциала, возникающий:
- •1) На границе металл-раствор соли этого металла
- •3) Вследствие различий в скоростях диффузии катионов и анионов
- •4) Между сторонами мембраны с избирательной проницаемостью
- •1) Зависит от активности (концентрации) анализируемых ионов
- •2) Окислительно-восстановительный
- •1) Стеклянный -
- •При электролизе раствора CaBr2 на аноде идет процесс окисления:
- •1) Стеклянный -
- •3) Хлорсеребряный -
- •2) Стеклянный -
- •3) Хлорсеребряный -
- •2) Окислительно-восстановительный
- •1) Зависит от активности (концентрации) анализируемых ионов
- •4) Концентраций катионов любого металла
- •2) Окислительно-восстановительный
Образцы тестов.
ЭДС
Вариант 1
Часть А
Электрохимическая схема электрода (полуэлемента) описывает:
1) окислительно-восстановительную способность пары металл-катион
2) зависимость электродного потенциала от активности ионов
3) зависимость электродного потенциала от температуры
4) состав электрода-металла и раствора
Величина потенциала никелевого электрода в 0,01 М растворе Ni(NO3)2 при Т=298К (е0=-0,25В) равна:
1) -0,309В
2) -0,191В
3) -0,220В
4) -0,280В
В порядке увеличения восстановительных свойств металлы расположены в ряду:
1) Na, Zn, Mg
2) Al, Ca, Ni
3) Hg, Al, Mg
4) Cu, Li, Al
Какое утверждение ошибочно :водородный электрод
1) характеризуется электродным потенциалом, определяющимся по формуле:
 =
+ 0,059 рН
=
+ 0,059 рН
2) относится к газовым электродам
3) характеризуется полуреакцией Н2«2Н++2е-
4) описывается электрохимической схемой: Pt,H2|2Н+
Какое утверждение ошибочно: хлорсеребряный электрод:
1) относится к обратимым электродам II рода
2) описывается электрохимической схемой: Ag| AgCl, Сl¯
3) характеризуется полуреакцией AgCl+ le- « Ag° + CI-
4) используется для определения pH биологических жидкостей как электрод определения
(индикаторный)
Электрод сравнения -это электрод,потенциал которого
1) применяется для характеристики окислительно-восстановительных свойств природных
соединений
2) практически постоянен и не зависит от протекания побочных реакций
3) зависит от активности (концентрации) анализируемых ионов
4) возникает в системе, состоящей из инертного металла и раствора, содержащего окислительно-восстановительную систему
Стеклянный электрод с Н+-функцией может использоваться для потенциометрического определения:
1) концентраций Na+ и Н+
2) только концентраций Na+
3) только концентраций Н+
4) концентраций катионов любого металла
Какое утверждение ошибочно: стеклянный электрод
1) имеет стеклянную мембрану (шарик) из специального стекла-литийбарий силикатного
2) используется как электрод определения при потенциометрическом определении рН
3) окислительно-восстановительный
4) описывается электрохимической схемой
Ag|AgCl |0,1 М раствор HClúстеклянная мембрана
внутренний внутренний
электрод раствор
сравнения
Окислительно-восстановительный потенциал - это скачок потенциала, возникающий:
1) на границе инертный металл-раствор, содержащий окислительно – восстановительную систему
2) на границе металл-раствор соли этого металла
3) вследствие различий в скоростях диффузии катионов и анионов
4) между сторонами мембраны с избирательной проницаемостью
Величина окислительно-восстановительного потенциала зависит от рН для следующей полуреакции:
1) Ag+ +1e- « Ago
2) Fe(CN) 63- + 1e-« Fe(CN)64-
3) Co+3 +1e- « Co+2
4) НАД+ + Н++2е- « НАДН
По международному соглашению (Стокгольм, 1953 г.) электрохимическая схема цепи (элемента) записывается:
1) справа - электрод с большим значением потенциала
2) справа – электрод с положительным значением потенциала
3) справа - электрод с меньшим значением потенциала
4) справа - можно поместить любой из 2-х используемых электродов
Стандартная ЭДС гальванического элемента(цепи)-это
1) ЭДС элемента, включающего стандартный водородный электрод
2) ЭДС элемента, состоящего из двух стандартных электродов
3) максимальное напряжение гальванического элемента
4) ЭДС элемента, включающего стеклянный электрод
Для определения рН .сока поджелудочной железы используется индикаторный электрод:
1) кадмиевый-Cdú Cd+2
2)
хлорсеребряный -
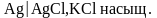
3)
стеклянный
-

4)
редокс (ферро-ферри) -

При потенциометрическом титровании в ацидо- или алкалиметрии в качестве индикаторного электрода (электрода определения) используется:
1) хлорсеребряный электрод
2) стандартный водородный электрод
3) стеклянный электрод
4) газовый кислородный электрод
Если два раствора НСl разной концентрации разделить пористой перегородкой, то на границе раздела возникает потенциал:
1) электродный
2) мембранный
3) электрический
4) диффузионный
Продукты коррозии оцинкованного железа в чистом влажном воздухе:
1) FeO, Fe(OH)2
2) Fe2O3, FeOOH, Fe(OH)3
3) ZnO, Zn(OH)2
4) ZnCl2, H2
При электрохимической коррозии зубных протезов, изготовленных из сплава Pd c Ag в слабокислой слюне, содержащей растворенный кислород:
1) Ag выполняет роль анода (растворяется, разрушается)
2) Ag выполняет роль катода
3) Pd- выполняет роль анода (растворяется, разрушается)
4) Pd-не участвует в создании гальванического элемента
Продукты электролиза раствора хлорида натрия
1) H2, Na, Cl2, NaOH
2) Na, Cl2, NaOH
3) H2, Na, Cl2, HCl
4) H2, Cl2, NaOH
Вариант 1 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
4 |
1 |
3 |
1 |
4 |
2 |
1 |
3 |
1 |
4 |
1 |
2 |
3 |
3 |
4 |
3 |
1 |
4 |
