
Лабораторна робота №1
Тема: кристалічний стан речовини
Обчислення енергії іонної кристалічної ґратки
Мета роботи: набути навичок по обчисленню енергії іонної кристалічної ґратки.
Завдання до роботи
З’ясувати особливості енергетичної структури іонних ґраток.
Вивчити метод розрахунку іонної ґратки за допомогою формули Борна.
Вивчити метод розрахунку іонної ґратки за допомогою циклу Борна - Габера.
Порівняти отримані результати.
Обладнання і матеріали
Довідникові данні енергетичних параметрів іонних кристалів, мікрокалькулятор, комп’ютер.
Теоретична частина
Під
енергією іонної кристалічної ґратки
розуміють роботу, яку необхідно зробити,
при постійній температурі й тиску, щоб
зруйнувати 1 моль іонного кристала з
утворенням газоподібних іонів, віднесені
один від одного на безмежність (у стані
“іонного газу”). У наведених умовах
робота дорівнює зміні енергії Гіббса
в процесі перетворення кристалу в іонний
газ. Традиційно енергія іонної кристалічної
ґратки позначається символом
![]() .
.
![]() (1.1)
(1.1)
Енергія
кристалічної ґратки при абсолютному
нулі
(0 К) може бути обчислена за допомогою
теорії М. Борна. В основі теорії лежить
припущення, що енергія іонного кристала
складається з енергії електростатичної
взаємодії іонів, відповідно до закону
Кулона й обмінної енергії відштовхування
цих іонів, що змінюється обернено -
пропорційно
![]() ступеню відстані між ними. При 0 К кожний
іон займає певне положення в кристалі,
яке відповідає мінімуму його енергії.
Отже, для того щоб обчислити величину
енергії іонної кристалічної ґратки,
досить просумувати енергії всіх вище
зазначених взаємодій, вважаючи заданим
положення кожного іона. Можна показати,
як здійснюються такі сумування для
кулонівської взаємодії. Для цього
розглянемо модель іонного кристала у
вигляді ланцюга знакозмінних іонів, що
мають однаковий за модулем заряд
ступеню відстані між ними. При 0 К кожний
іон займає певне положення в кристалі,
яке відповідає мінімуму його енергії.
Отже, для того щоб обчислити величину
енергії іонної кристалічної ґратки,
досить просумувати енергії всіх вище
зазначених взаємодій, вважаючи заданим
положення кожного іона. Можна показати,
як здійснюються такі сумування для
кулонівської взаємодії. Для цього
розглянемо модель іонного кристала у
вигляді ланцюга знакозмінних іонів, що
мають однаковий за модулем заряд
![]() і розташованих один від одного на
відстані
і розташованих один від одного на
відстані
![]() ,
як це показано на рис.1.1.
,
як це показано на рис.1.1.
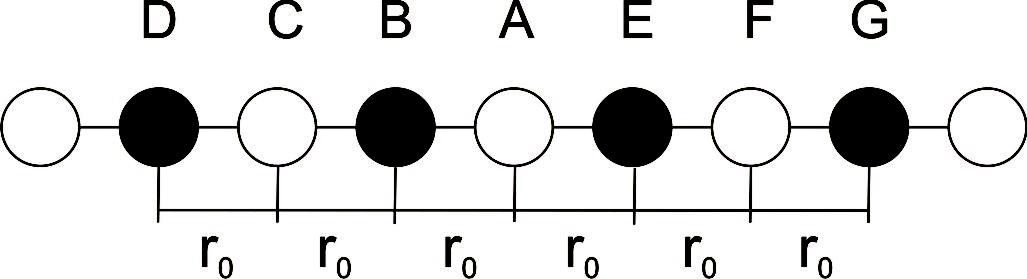
Рис.1.1. Схематичне зображення іонів у кристалічній ґратці.
У цьому випадку аніон A зазнає кулонівського притягання двох безпосередніх сусідів: катіонів В та Е, потенційна енергія взаємодії з якими в системі СІ, дорівнює:
![]()
Одночасно
іон А відштовхується від однойменних
аніонів
C і F, які знаходяться на відстані
![]() від нього;
енергія
цієї взаємодії запишеться як:
від нього;
енергія
цієї взаємодії запишеться як:
![]()
(енергія притягання приймається негативною, а енергія відштовхування - позитивною).
Загальна кулонівська енергія взаємодії іона А з усіма іонами ланцюга може бути представлена у вигляді:
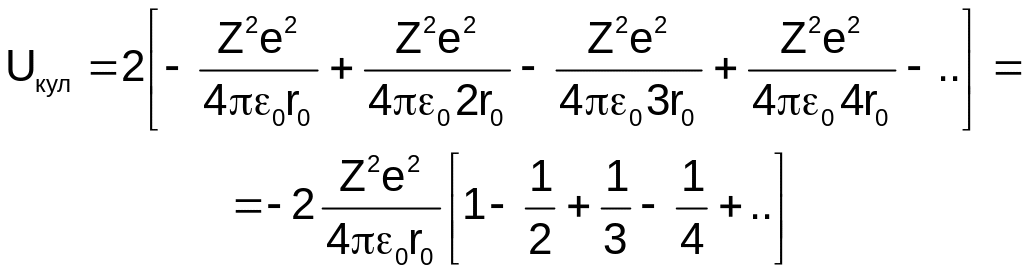 (1.2)
(1.2)
Характерною рисою виразу (1.2) є те, що його можна представити у вигляді добутку енергії:
![]()
взаємодії
двох іонів, які перебувають на рівноважній
відстані один від одного (![]() ).
Ця величина, визначається лише структурою
розглянутої системи і незалежить від
зарядів іонів та відстані між ними:
).
Ця величина, визначається лише структурою
розглянутої системи і незалежить від
зарядів іонів та відстані між ними:
![]()
Сума ряду, записаного в дужках, дорівнює ln2, тому можна записати, що
![]() (1.3)
(1.3)
Буквою М в останньому виразі позначена константа Маделунга, яка отримала назву на честь вченого, який розрахував її значення для основних типів кристалів. Константа Маделунга відображає розташування іонів у просторі та визначається типом розглянутої кристалічної структури.
Узагальнюючи
розглянутий приклад на випадок тривимірних
іонних кристалів, що складаються з іонів
однакового заряду, зазначимо, що повну
енергію кулонівської взаємодії одного
іона з іншою частиною кристала завжди
можна записати у вигляді добутку енергії
взаємодії елементарних структурних
одиниць (іонів) і геометричного фактора
(константи Маделунга). Так, для кристалів
кам'яної солі NaCl, де кожний іон у
просторі
оточений 6 іонами протилежного заряду
(координаційне число дорівнює 6),
розташованими на відстані
і
12-ти
іонами з
однаковим
зарядом на відстані
![]() ,
розрахунок приводить до
,
розрахунок приводить до
![]() .
У цей час розроблені математичні методики
розрахунків М для ґраток різних типів.
Для деяких з них величини М наведені в
табл.1.1.
.
У цей час розроблені математичні методики
розрахунків М для ґраток різних типів.
Для деяких з них величини М наведені в
табл.1.1.
Якщо
знехтувати можливими спотвореннями
реальної структури кристала, впливом
поверхневих ефектів на його властивості
та вважати, що всі іони кристала
перебувають в однаковому оточенні, то
можна знайти повну електростатичну
енергію 1 моля кристала. Як відомо, 1 моль
іонного кристала містить Na
позитивно
заряджених і Na
негативно заряджених іонів (Na
- число Авогадро,
![]() ).
Для кожного із цих іонів енергія взаємодії
з ґраткою
кристала визначається виразом (1.3), тому
кулонівську енергію іонного кристала
можна записати в наступному вигляді:
).
Для кожного із цих іонів енергія взаємодії
з ґраткою
кристала визначається виразом (1.3), тому
кулонівську енергію іонного кристала
можна записати в наступному вигляді:
![]() (1.4)
(1.4)
Множник
![]() у
виразі
з'явився у зв'язку з тим, що кожну пару
іонів при розрахунку енергії ми повинні
враховувати лише один раз. Елементарний
заряд
у
виразі
з'явився у зв'язку з тим, що кожну пару
іонів при розрахунку енергії ми повинні
враховувати лише один раз. Елементарний
заряд
![]() .
.
Таблиця 1.1. Константи Маделунга деяких кристалічних ґраток
|
F |
Cl |
Br |
I |
Li |
1,7500 |
1,7523 |
1,75341 |
1,7562 |
Na |
1,7454 |
1,74756 |
1,7461 |
1,7437 |
K |
1,7338 |
1,7343 |
1,7379 |
1,7381 |
Rb |
1,7591 |
1,7589 |
1,7582 |
1,7576 |
Вираз (1.4) може бути узагальнено для випадку іонних кристалів, які складаються з іонів різного заряду:
![]() (1.5)
(1.5)
де
через
![]() позначені заряди катіона й аніона.
позначені заряди катіона й аніона.
Відповідно до теорії Борна, при розрахунках енергії кристала варто взяти до уваги й енергію обмінного відштовхування, що виникає через перекривання електронних орбіталей іонів при їх зближенні. Для двох взаємодіючих іонів ця енергія може бути записана у такому вигляді:
![]() ,
(1.6)
,
(1.6)
де
![]() - константа енергії відштовхування,
- константа енергії відштовхування,
![]() - відстань між іонами, а
- відстань між іонами, а
![]() -
постійна,
яка характеризує залежність енергії
обмінного відштовхування іонів від
відстані між ними. Розглядаючи енергію
обмінного відштовхування іонів у
кристалі, необхідно провести сумування
по всіх парах взаємодіючих іонів, а
потім додати енергією кулонівської
взаємодії. Однак можна зробити по-іншому.
Припустимо, що нам вдалося обчислити
суму енергій відштовхування (1.6) і
представити її у вигляді добутку величин,
обумовлених законом взаємодії двох
іонів та геометрією кристала:
-
постійна,
яка характеризує залежність енергії
обмінного відштовхування іонів від
відстані між ними. Розглядаючи енергію
обмінного відштовхування іонів у
кристалі, необхідно провести сумування
по всіх парах взаємодіючих іонів, а
потім додати енергією кулонівської
взаємодії. Однак можна зробити по-іншому.
Припустимо, що нам вдалося обчислити
суму енергій відштовхування (1.6) і
представити її у вигляді добутку величин,
обумовлених законом взаємодії двох
іонів та геометрією кристала:
![]() (1.7)
(1.7)
Відповідно
до визначення М.Борна, повну енергію
іонного кристала можна представити як
суму
![]() ,
взяту з оберненим знаком:
,
взяту з оберненим знаком:
 (1.8)
(1.8)
Оскільки
![]() ,
являє собою рівноважну відстань між
іонами в кристалі, то вона повинна
відповідати умові мінімуму енергії
ґратки:
,
являє собою рівноважну відстань між
іонами в кристалі, то вона повинна
відповідати умові мінімуму енергії
ґратки:
![]() (1.9)
(1.9)
Продиференціювавши (1.8) по і прирівнявши отриману похідну до нуля, отримаємо рівняння:
 (1.10)
(1.10)
з якого можна визначити величину:
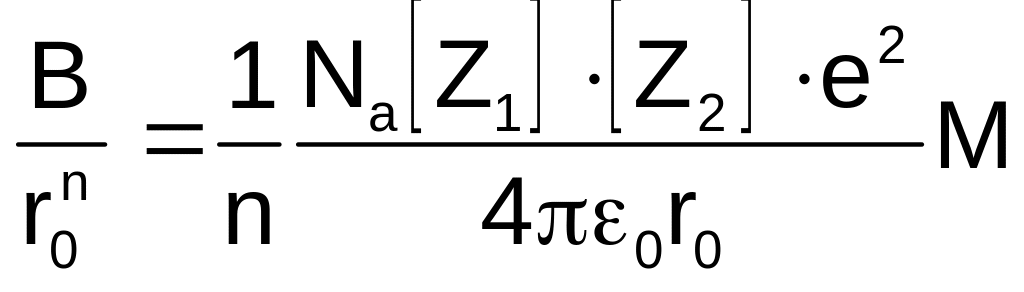 (1.11)
(1.11)
Підставляючи останній вираз в (1.8), отримаємо формулу Борна для енергії кристалічної ґратки:
![]() (1.12)
(1.12)
Величину зазвичай знаходять із даних по ізотермічному стисканні іонних кристалів. Для ґраток галогенідів лужних металів значення n наведені в табл.1.2.
Заряд
катіона або аніона
![]() визначається згідно зі здатністю
відповідної речовини приймати або
віддавати електрони і задаються як:
Li+,
K+,
Na+,
Rb+,
Cs+,
Cl-,
Br-,
I-,
F-.
визначається згідно зі здатністю
відповідної речовини приймати або
віддавати електрони і задаються як:
Li+,
K+,
Na+,
Rb+,
Cs+,
Cl-,
Br-,
I-,
F-.
Іонні
радіуси для відповідних речовин
розраховуються як
![]() ,
де
,
де
![]() - іонний радіус аніона,
- іонний радіус аніона,
![]() - іонний радіус катіона, наведені у табл.
1.2.
- іонний радіус катіона, наведені у табл.
1.2.
Таблиця 1.2. Іонні радіуси для відповідних речовин
|
Іонні
радіуси,
о 1 А= 10-10 м = 0,1 нм
|
Li+ |
0,73 |
Na+ |
1,13 |
K+ |
1,51 |
Rb+ |
1,66 |
Cs+ |
1,81 |
F- |
1,17 |
Cl- |
1,67 |
Br- |
1,82 |
I- |
2,06 |
Таким
чином, у теорії Борна розглядається
статична гратка іонного кристалу, тому
енергія іонної кристалічної гратки,
яка розраховується згідно з (1.12), не
містить у собі енергію теплового та
коливального рухів іонів. З фізичної
точки зору саме це означає, що енергія,
яка обчислюється згідно теорії Борна,
відноситься до абсолютного нуля
температури (![]() К).
Відповідно до теплової теореми Нернста:
К).
Відповідно до теплової теореми Нернста:
![]() .
Тому при нулі Кельвіна енергія іонної
кристалічної гратки буде збігатися із
значенням теплового ефекту її руйнування:
.
Тому при нулі Кельвіна енергія іонної
кристалічної гратки буде збігатися із
значенням теплового ефекту її руйнування:
![]() (1.13)
(1.13)
Таблиця 1.3. Значення параметра n галогенідів лужних металів
|
F |
Cl |
Br |
I |
Li |
5,86 |
6,66 |
7,00 |
6,15 |
Na |
8,00 |
8,16 |
8,02 |
7,98 |
K |
8,05 |
8,87 |
9,08 |
9,29 |
Rb |
8,80 |
8,12 |
8,72 |
9,49 |
Cs |
13,0 |
13,1 |
13,2 |
12,7 |
Величини GT і НТ при температурі Т, відмінної від нуля, будуть розрізнятися між собою на (TST).
Величину
енергії, яка розраховується згідно з
рівнянням Борна
![]() ,
можна
визначити іншим способом, наприклад, з
т.зв. циклу Борна-Габера. Кристал
галогеніда лужного металу можна
синтезуватися двома різними шляхами:
безпосередньо із простих речовин (I) і
шляхом їхніх послідовних перетворень
(П), які наведені на рис 1.2.
,
можна
визначити іншим способом, наприклад, з
т.зв. циклу Борна-Габера. Кристал
галогеніда лужного металу можна
синтезуватися двома різними шляхами:
безпосередньо із простих речовин (I) і
шляхом їхніх послідовних перетворень
(П), які наведені на рис 1.2.
Цикл замкнутий, тому відповідно до закону Гесса, сумарна зміна ентальпії Нi = 0:
Н1 + Н2 + Н3 + Н4 + HX - H5 = 0 (1.14)
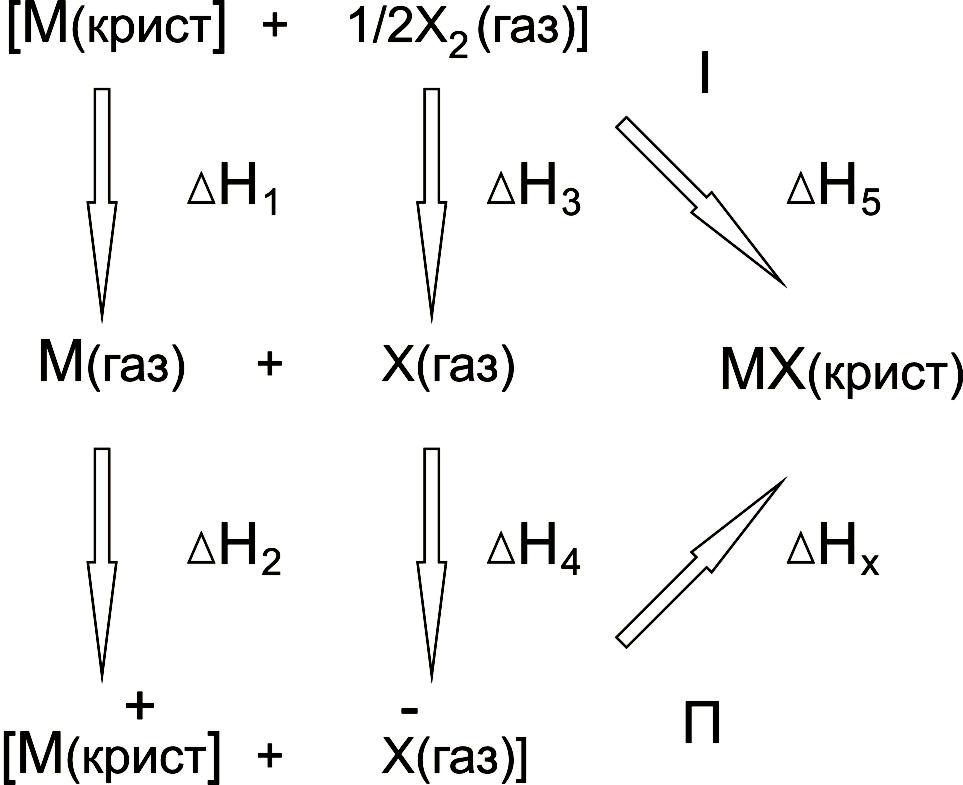
Рис. 1.2. Шляхи синтезу кристалу галогеніда лужного металу
Стандартні значення змін ентальпії для процесів 1 - 5 можна знайти з довідника, а з рівняння (1.14) обчислити величину НХ, що дорівнює зміні ентальпії утворення кристала, взятому зі зворотним знаком -НХ = Нгратки.
Розглянемо докладно розрахунок теплового ефекту руйнування кристалічної ґратки NaCl при T = 298 К.
1. Na(крист) Na(газ) Н1 = 108,8 кДж/моль
2. Na(газ) Na+(газ) Н2 = 496,9 кДж/моль
3. 1/2Cl2(газ) Cl (газ) Н3 = 121,6 кДж/моль
4. Cl(газ) Cl-(газ) Н4 = -365,8 кДж/моль
5. Na(крист) + 1/2Cl2(газ) NaCl(крист) Н5 = -411,5 кДж/моль
З урахуванням виразу (1.14) отримаємо -НХ = 108,8 + 496,9 + 121,6 – 365,8 + 411,5 = 773,0 кДж/моль
Таким чином, як насліддок розгляду циклу Борна - Габера можна визначити тепловий ефект руйнування кристалічної ґратки Нгратки при будь-якій температурі Т. Як ми вже зазначали вище, величина цього ефекту при 0 К дорівнює енергії іонної кристалічної ґратки U, розрахованої в рамках теорії Борна.
Тому для порівняння значень енергії кристалічної гратки U, отриманої по формулі Борна та із циклу Борна - Габера, необхідно величину теплового ефекту руйнування іонного кристала при 298 К (Нгратки) перерахувати на нуль Кельвіна. Таке перерахування можна зробити за допомогою рівняння Кірхгофа, розглядаючи процес руйнування іонного кристала як квазіхімічну реакцію:
NaCl Na+(газ) + Cl-(газ) (1.15)
Н0
=
Нгратки
(298) + +![]()
(1.16)
Перший інтеграл легко обчислюється, якщо прийняти іонний газ за ідеальний одноатомний газ, мольна теплоємність Ср якого дорівнює (5/2·R). Для обчислення другого інтеграла необхідно провести графічне інтегрування від 10 до 298 К з використанням наявних у довідниках табличних значень теплоємності Ср[NaCl(крист)].
Підставивши в рівняння (1.16) значення інтегралів і величину Нгратки (298 К), розраховану із циклу Борна - Габера, можна отримати Н0 = U.
