
- •Конспект 9-11. Хімічна кінетика. Вплив природи і концентації реагуючих речовин на швидкість реакцій.
- •Класифікація хімічних реакцій
- •І. Прості
- •Іі. Складні
- •Хімічна кінетика. Вплив температури та каталізаторів на швидкість шімічних Основні поняття, визначення, формули.
- •Каталітичні процеси.
- •Біологічні каталізатори – ферменти
Конспект 9-11. Хімічна кінетика. Вплив природи і концентації реагуючих речовин на швидкість реакцій.
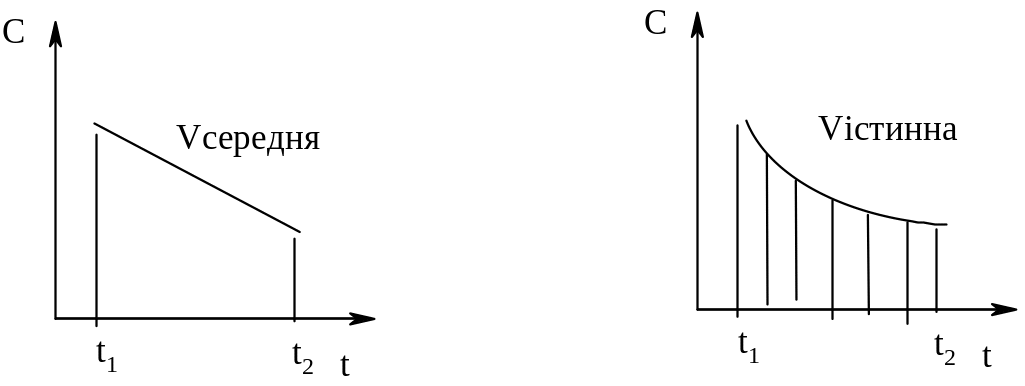
 Швидкість
хімічних реакцій - відношення зміни
концентрації реагуючих речовин за
одиницю часу, в одиниці, об’єму. Значення
середньої швидкості реакції виражається:
Швидкість
хімічних реакцій - відношення зміни
концентрації реагуючих речовин за
одиницю часу, в одиниці, об’єму. Значення
середньої швидкості реакції виражається:
- за зміною продуктів реакції
С2 – С1 С С dС
V = = = lіmt0 = =
t2 – t1 t t dt
- за зміною концентрацій вихідних речовин:
dС
V = -
dt
Концентрація вихідних речовин зменшується а часом, тому права частина має знак мінус. Одночасно концентрація продуктів реакції збільшується тому рівняння швидкості має знак плюс.
Істинну швидкість реакції можна визначити тільки в даний момент як нескінчено малу зміну концентрації речовин dС, що відбувається за нескінченно малий проміжок часу dt.
Таким чином, хімічна кінетика визначає поняття швидкості гомогенної хімічної реакції як зміну концентрації одного з реагуючих компонентів за одиницю часу в одиниці об’єму при постійній температурі:
dС 1
V = ·
dt V
де V - об’єм реагуючої суміші
Швидкість гетерогенних реакцій зумовлена кількістю молекул або молів даної речовини, що реагують за одиницю часу на одиниці поверхні поділу фаз:
dС 1
V = ·
dt S
де S – поверхня, на якій проходить реакція.
На швидкість гомогенних хімічних реакцій впливають: природа реагуючих речовин, концентрація реагентів, температура, тиск, природа розчинника, наявність каталізатора. Швидкість гетерогенних реакцій значною мірою залежить, крім названних факторів, ще й від поверхні поділу фаз.
Швидкість хімічних реакцій в гетерогенних системах пропорційна поверхні дотику реагуючих речовин VS дотику. В гомогенних системах реакції проходять за простішим механізмом і з більшою швидкістю. Тому, при можливості, речовини переводять в газоподібну чи рідку (розчини) фазу.
Речовини за природою більше і менше реакційно здатні
Н2 + F2
2НF Н2 + Сl2
2НСl Н2 + І2
![]() 2НІ
2НІ
вибух горять оборотня реакція
Концентрація реагуючих речовин впливає на швидкість хімічних реакцій за законом діючих мас - основним законом хімічної кінетики: швидкість хімічної реакції при постійній температурі прямопропорційна добутку концентрацій реагуючих речовин в невеликих степенях (коефіцієнтів в стехіометричному рівнянні)
аА + вВ dD;
V = К[А]а·[В]в; V = КСаА·СвВ ; V = КРаА·РвВ
Р - парціальні тиски реагуючих гавів;
К - коефіцієнт пропорційності - константа швидкості хімічної реакції. К = V при [А] = [В] = 1 моль/л. Якщо концентрації реагуючих речовин дорівнюють одиниці, то константа швидкості чисельно дорівнює швидкості реакції. Це і є фізичний зміст константи швидкості.
Фізичний вміст закону діючих мас - при збільшені концентрації збільшується число реагуючих частинок в одиниці об’ему, збільшується кількість зіткнень між частинками і, як наслідок, збільшується швидкість хімічних реакцій.
Молекулярність реакції - це число частинок, які беруть участь в елементарному акті реакції.
Н2О2 Н2О; Н2 + Сl2 2НСl; 2Н2 + О2 2Н2О
мономолекулярна біомолекулярна тримолекулярна
Порядок реакції - сума показників степенів при концентраціях реагуючих речовин в рівнянні закону діючих мас. (Показники степеней встановлюються експериментально) (n = а + в).
Якщо хімічні реакції протікають в одну стадію то порядок і молекулярність співпадають. В більш складних процесах не співпадають. Поняття порядок реакції принципово відмінне від поняття молекулярність.
Молекулярність реакції - поняття теоретичне. Щоб встановити молекулярність, треба уявляти, через взаємодію яких молекул та які стадії перебігає реакція.
На відміну від молекулярності, порядок реакції - експериментальна величина.
Порядок реакції визначають за виглядом рівняння, яке відображає експериментальну залежність швидкості даної реакції від концентрації реагуючих речовин. Розрівняють реакції першого (V = КС), другого (V = КС2), третього (V = КС3), а також нульового та дробового порядків.
Швидкість хімічних реакцій вивчають у статичних умовах, визначаючи зміну в часі концентрації однієї з реагуючих речовин у реакційній суміші постійного об’єму.
Кінетичне рівняння реакції дає змогу розрахувати константи швидкості та період напівперетворення t1/2.
Реакції нульового порядку (швидкість їх не залежить від концентрації).
С0 – С
(n = 0); V = К0; К0 =
t
Період напіврозпаду - час, за який концентрація вихідних речовин зменшується на половину:
С0 С0
С = ; t1/2 =
Ко
Графічно виражається лінією: (див.рис.)
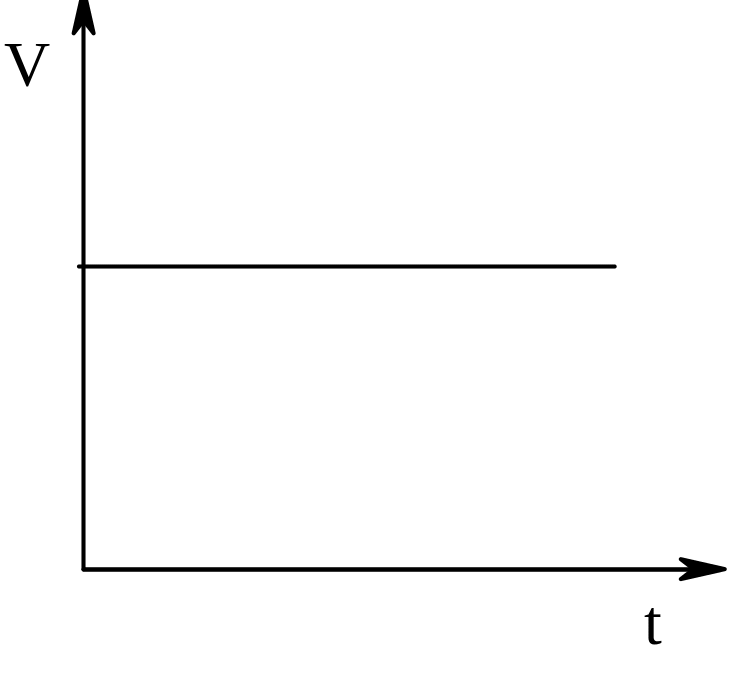
До реакцій нульового порядку належать ферментативні процеси, при яких субстрат перебуває в надлишку, а кількість ферменту обмежена. Нульовий порядок спостерігається в гетерогенних реакціях, де швидкість надходження речовини більша від швидкості її витрачання.
Кількість речовини х, що прореагувала за час t, можна розрахувати, якщо прийняти С0 = а/V і Сt = (а-х)/V і ввести у кінетичне рівняння реакції нульового порядку:
х
К0t = ——,
V
де а - початкова концентрація реагенту при t = 0; х - кількість речовини, що прореагувала за час t; V - об’єм реагуючої суміші. При V = соnst, ·х = К·t.
Реакції першого порядку (в рівняння швидкості входить концентрація реагуючої речовини в першій степені)
dС dС
(n = 1); V = К1С; V = ; К1С =
dt dt
інтегруємо і отримуємо:
2,303 С0 ln2 0,693
К1 = · lg ; Сt = С0еКt; t1/2 = =
t Сt К1 К1
де К1 - константа швидкості реакції першого порядку; С0 – концентрація вихідної речовини в початковий момент; Сt – концентрація вихідної речовини в момент часу t, від початку реакції; t1/2 - період напівперетворення.
Таким чином, для реакцій першого порядку період напівперетворення не залежить від початкової концентрації реагуючих речовин. Незалежно від значення початкової концентрації половина кількості речовини прореагує за один і той же час.
Кількість речовини х що прореагувала за час t можна визначити, якщо припустити, що С0 = а/V і Сt = (а-х)/V, і ввести ці значення в рівняння реакції першого порядку. В результаті одержимо:
2,303 а
К1 = · lg ;
t а-х
де а - концентрація на початку реакції;
х - кількість речовини, яка прореагувала за t;
V - об’єм реакційної суміші.
До реакцій першого порядку належить кінцеві стадії ферментативних процесів, реакції антигенів з антитілами, ізомерного перетворення, гідролізу та ін.
Реакції другого порядку (швидкість їх пропорційна квадрату концентрацій)
1 dС 1 С0-Сt
(n = 2); V = К1С2; К2 = · ; К2 = ·
t dt t С0·Сt
Період напівперетворення:
1
t1/2 =
К2С
Період напівперетворення для реакцій другого порядку обернено пропорційний початковій концентрації реагуючих речовин. Чим вища початкова концентрація, тим за більш коротший час буде витрачена її половина. У біохімічних процесах реакції вищого ніж другий не зустрічаються.
 Одна
з варіацій графічного методоу: будують
графік залежності lgV від lgС. Отримують
лінійну залежність і через tg визначають
порядок реакції згідно приведеним
формулам.
Одна
з варіацій графічного методоу: будують
графік залежності lgV від lgС. Отримують
лінійну залежність і через tg визначають
порядок реакції згідно приведеним
формулам.



