
III. Экспериментальная часть: Приборы.
Колбы вместимостью 500 мл. Стаканы химические вместимостью 100мл. Стеклянные палочки. Воронка. Пипетка. Штатив. Фильтровальная бумага. Электроплитка. Сетка асбестированная. Электрическая мешалка. Термометр. Весы техно-химические. Шпатель. Микроскоп. Предметные стекла. Бюретка вместимостью 25 мл. Цилиндр вместимостью 100мл.
Реактивы.
Буровая вода. Раствор аммиака (ч.д.а.) с плотностью 0,894 г/мл. Мочевина(0,5%). Дистиллированная вода. Хлороводородная кислота (0,1н). Раствор щелочи(0,1н). Индикатор - фенолфталеин.
Ход работы:
Уравнение реакции : Mg2+ + 2NH4OH→Mg(OH)2↓+2NH4+
w (Mg2+)=2%.
m (раствора)=150г
1) Очистка исследуемой воды от примесей тяжелых металлов.
Для этого на 150 мл исследуемой воды добавляется 1 капля раствора аммиака (ч.д.а.) с плотностью 0,894 г/мл. Образовываются осаждения бурого цвета. После этого данный раствор отфильтровывается.
2) Расчет реагентов.
На 590 мл исследуемой воды (w (Mg2+)=20%.) потребовалось 2,95г мочевины и 263мл раствор аммиака. Для нашего случая:
590г – 2,95г
150г - Хг
![]() мочевины при
(w(Mg2+)=20%.),
тогда при w(Mg2+)=2%
мочевины потребовалось 0,075г.
мочевины при
(w(Mg2+)=20%.),
тогда при w(Mg2+)=2%
мочевины потребовалось 0,075г.
Потребовалось раствора аммиака
590мл – 263мл
150мл – Yмл
![]() раствор аммиака
при (w(Mg2+)=20%.),
тогда при w(Mg2+)=2%
аммиака потребовалось 6,68мл.
раствор аммиака
при (w(Mg2+)=20%.),
тогда при w(Mg2+)=2%
аммиака потребовалось 6,68мл.
Очищенный от примесей раствор нагрели на электроплитке до 50ºС и при перемешивании добавили 0,075г мочевины, и затем вводили в течении 50 мин 6,68 мл раствора аммиака(по 1мл раствора каждые 10 минут).
Перемешивание проводили в течении полутора часа пр поддержании
t=50 ºС.
Полученную суспензию охладили, отфильтровали и оставили до полного высыхания в течении двух суток. Масса высушенного осадка составила 0,14г.
3) Расчет соляной кислоты для нейтрализации Mg(oh)2.
Mg(OH)2 + 2HCl→MgCl2 + 2H2O
n(HCl)=2n( Mg(OH)2)


Для растворения 0,14г гидроксида магния потребовалось 48мл кислоты, из этого следует, что в избытке будет 60мл.
Чтобы нейтрализовать избыток раствора кислоты ее титровали с помощью раствора щелочи. Для этого добавили 3-4 капли фенолфталеина, после чего и по каплям из бюретки добавляли раствор щелочи до появления слабо-розовой окраски индикатора, которая была устойчива в течении 2-3 минут. Объем раствора щелочи составил 41,2мл. Тогда на растворение гидроксида магния пошло 60-41,2=18,8мл кислоты.
4)Расчет практического выхода Mg(OH)2.
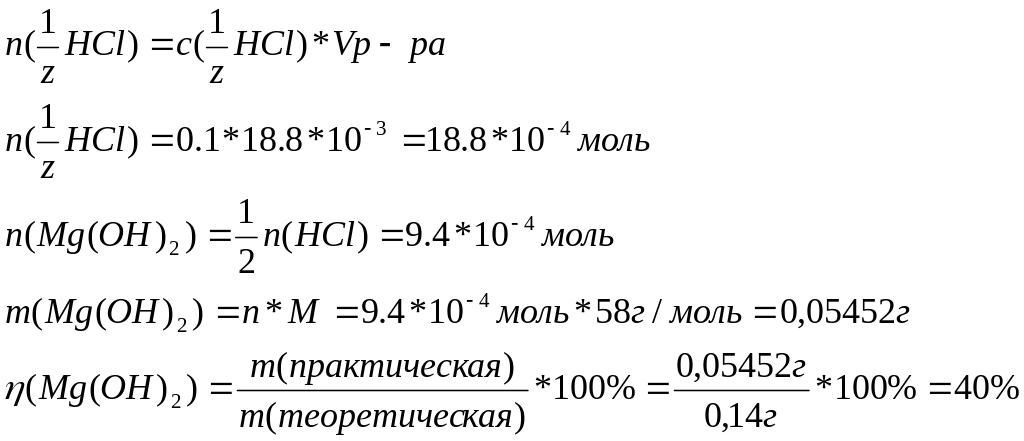
5) Рассмотрение кристаллов Mg(OH)2 под микроскопом.

Характеристика: кристаллы Mg(OH)2 мелкодисперсные, бесцветные, правильной гексагональной формы.
IV. Выводы:
В ходе работы был получен мелкодисперсный порошкообразный Mg(OH)2, с выходом продукта 40 %.
V. Список литературы:
1. Fricke R., Schnabel R., Beck K., Z. Electrochem., 42,881(1936).
2. Fricke R., et al., Z. Electrochem., 41, 174 (1935); Z. Anorg. Allgem. Chem., 166, 255(1927).
3. DeSchulten A., C. R. Acad. Sci. Paris, 101, 72 (1885).
4. Giauque W. F., Archibald R. C., J. Amer. Chem. Soc., 59, 561 (1937).
5. Иванов А.И., Ляндрес М.Б., Прокофьев О.В. Производство магния. М., 1979, c,22.
6. Патент США N 3829559, кл. 423-497, опублик. 1974
7. Патент РФ N 2069176, опублик. 20.11.1996
