
- •Розділ 12. Біохімія крові
- •12.1. Функції крові
- •12.2. Гемоглобін
- •12.2.2. Похідні гемоглобіну. Молекула гемоглобіну, взаємодіючи з різними лігандами, утворює похідні (рис. 12.2).
- •12.3. Буферні системи крові
- •12.4. Білки плазми крові
- •12.5. Ферменти плазми крові
- •12.6. Небілкові органічні сполуки плазми крові
- •12.7. Згортальна та фібринолітична системи крові
- •12.8. Біохімічні основи імунної системи
- •12.9. Біохімічні механізми імунодефіцитних станів
12.8. Біохімічні основи імунної системи
Імунна система — анатомо-функціональна система організму вищих тварин і людини, яка виконує захисні функції щодо підтримання внутрішнього антигенного гомеостазу. Антигени – це високомолекулярні сполуки, які є генетично чужорідними для даного організму і викликають специфічну імунну реакцію, спрямовану на їх відторгнення та елімінацію. Антигенні властивості мають переважно біомакромолекули — білки, нуклеїнові кислоти, деякі полісахариди та, у низці випадків, синтетичні полімери. Імунна система за допомогою клітинних і гуморальних механізмів забезпечує розпізнавання, зв'язування та руйнування антигенів як інфекційного, так і неінфекційного походження.
Морфологічним синонімом імунної системи є лімфоїдна система. Вона складається з загруднинної залози (тимуса), селезінки, лімфатичних вузлів і фолікулів, лімфоцитів кісткового мозку та крові. Крім лімфоцитів, у реакціях імунітету беруть участь численні білки та пептиди, що є ефекторами імунних процесів, — імуноглобуліни, компоненти системи комплементу, гормони та медіатори імунітету.
Попередниками лімфоцитів є ембріональні стовбурові клітини кісткового мозку, що утворюються на ранніх етапах внутрішньоутробного розвитку. Вони поділяються на В- та Т-лімфоцити, останні включають Т-кілери( Тк), що зумовлюють процеси клітинного імунітету; Т-хелпери, що індукують проліферацію, трансформацію В-лімфоцитів; Т-супресори (Тс), що пригнічують розвиток реакцій гуморального та клітинного імунітету, сприяють формуванню стану імунологічної толерантності.
В-лімфоцити є ефекторами гуморального імунітету, попередниками антитілоутворюючих плазматичних клітин, — основних продуцентів антитіл (імуноглобулінів). Рецепторами для антигенів на поверхні В-лімфоцитів слугують специфічні поверхневі імуноглобуліни. Взаємодія цих рецепторів з антигеном супроводжується диференціацією В-лімфоцитів у плазматичні клітини та генними транслокаціями, що призводять до формування ділянок ДНК, відповідальних за транскрипцію відповідних антитіл. Розглянута система є специфічною відносно хімічної природи антигенів і формується внаслідок взаємодії організму з чужорідними макромолекулами, тобто в процесі "імунологічного навчання".
Розрізняють також вроджену систему неспецифічного імунітету або систему неспецифічних факторів захисту організму, яка зумовлює однотипні клітинні та біохімічні реакції на будь-які чужорідні антигени. До неспецифічних факторів захисту належать фагоцити (макрофаги тканин, нейтрофіли та моноцити крові), система комплементу і білки "гострої фази" запалення. Ті з них, що мають бактерицидні властивості, виступають у ролі інгібіторів бактеріальних протеїназ (лізоцим, пропердин, а-макроглобулін, а1 -інгібітор протеїназ тощо) і беруть участь у реалізації реакцій фагоцитозу.
12.8.1. Імуноглобуліни. Імуноглобуліни — клас білків, що є ефекторами гуморального імунітету, і виконують функцію антитіл, взаємодіючи з генетично чужорідними макромолекулами — антигенами. У крові людини імуноглобуліни мають електрофоретичні властивості γ-глобулінів, становлять до 20% від маси всіх білків плазми.
Імуноглобуліни синтезуються плазматичними клітинами, які є продуктами трансформації В-лімфоцитів, що відбувається при стимуляції імунної реакції організму на надходження чужорідних білків, клітин (мікроорганізмів, найпростіших), при інфекційних захворюваннях, за умов вакцинації, пересадки органів і тканин, переливання крові, злоякісного перетворення клітин власного організму.
Молекули імуноглобулінів — глікопротеїни, білкова частина яких є тетрамером, що складається з чотирьох поліпептидних ланцюгів: двох тяжких Н-ланцюгів (від англ. heavy — тяжкий), та двох легких L-ланцюгів (від англ. light — легкий). У кожній окремій молекулі імуноглобуліну тяжкі та легкі ланцюги попарно однакові, тобто умовна формула будь-якого імуноглобуліну має вигляд Н2L2.
Н-ланцюги імуноглобулінів складаються приблизно з 220 амінокислотних залишків, їх молекулярна маса становить 50 – 70 кДа, а L-ланцюги – із 110 амінокислотних залишків, їх молекулярна маса – 20 – 25 кДа. Окремі поліпептидні ланцюги в молекулах імуноглобулінів сполучаються між собою дисульфідними зв'язками.
Олігосахаридні залишки, що складаються з залишків манози та N-ацетилглюкозаміну, зв'язані з Н-ланцюгами з боку С-кінців.
У кожному з Н- або L-ланцюгів молекул імуноглобулінів можна виділити окремі домени, що відрізняються за структурою та мають певне функціональне значення.
Константні ділянки (С-ділянки) – домени, що характеризуються сталістю амінокислотного складу в різних класах імуноглобулінів. Вони розміщуються з С-кінців L- та Н-ланцюгів і займають ½ довжини L-ланцюга та ¾ довжини Н-ланцюга (ділянки Сн1, Сн2, Сн3) (рис. 12.15).
Варіабельні ділянки (V-ділянки) розміщуються з N-кінців L- та Н-ланцюгів. Вони займають приблизно ½ довжини L-ланцюга (VL) та ¼ довжини Н-ланцюга (Vн) і характеризуються мінливістю амінокислотного складу. За допомогою амінокислотних залишків своїх гіперваріабельних кінцевих ділянок вони беруть участь у формуванні активного центру молекули імуноглобуліну, який за своєю конформацією комплементарний детермінантним групам антигену і забезпечує зв'язування з ним, тобто специфічність імуноглобуліну.
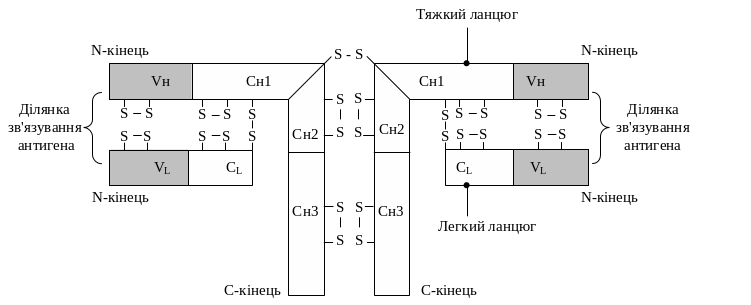
Рис. 12.15. Схема будови імуноглобуліну
За умов розщеплення імуноглобулінів папаїном, яке відбувається в шарнірній частині молекули, утворюються два антигензв'язуючі фрагменти Fab (antigen binding fragment) та фрагмент, що кристалізується, – Fc.
Різні типи тяжких і легких ланцюгів у молекулах імуноглобулінів позначають літерами грецького алфавіту. Відповідно до такої номенклатури розрізняють п'ять типів Н-ланцюгів (α, γ, μ, δ, ε ) і два типи L-ланцюгів(χ, λ). Залежно від типу тяжкого ланцюга виділяють п'ять класів імуноглобулінів (IgA, IgD, IgE, IgG, IgM), у складі кожного з яких певний тип Н-ланцюга сполучається з одним із двох типів L-ланцюга. Властивості імуноглобулінів крові людини подано в табл. 12.4
Таблиця 12.4. Біохімічна характеристика окремих класів імуноглобулінів людини
Клас |
Структура/маса молекули (кДа) |
Характеристика класу / концентрація в сироватці крові (г/л) |
IgG
|
χ2γ2 або λ2γ2 / 150 |
Продукт вторинної імунної відповіді, мономер, ефективно зв’язує чужорідні молекули і клітини, полегшує їх подальше знищення. Активує систему комплементу та фагоцитоз. Проходить через плацентарний бар'єр, захищає ембріон від інфекції / 10 – 15 |
IgM
|
(χ2μ2)5 або (λ2μ2)5 / 800 – 960 |
Існує в двох формах – мономерній і пентамерній (має 10 активних центрів). При взаємодії антигена з першою формою відбувається розмноження В-лімфоциті, а з другою – індукується зв’язування з першим компонентом системи комлементу / 1,5 – 3,5 |
IgA
|
(χ2α2)1-4 або (λ2α2)1-4 / 180 – 720 |
Продукт секреторних залоз, знаходиться в слині, молоці, травних соках, секреті дихальних шляхів. На базальній поверхні епітеліоцитів зв’язується з секреторним компонентом, утворюючи з ним комплекс, який проникає всередину клітини і там підлягає дії протеолітичних ферментів з утворенням димера. Не взаємодіє з системою комплемента і фагоцитами, але запобігає прикріпленню антигенів до поверхні епітеліоцитів і проникнення антигенів в організм / 1 – 5 |
IgD
|
χ2δ2 або λ2δ2 / 160-180
|
Мономер, відіграє роль рецепторів В-лімфоцитів / 0,03 |
IgE |
χ2ε2 або λ2ε2 / 185 – 190 |
Мономер, зв'язується з рецепторами опасистих клітин і базофілів і виступає рецепторами антигенів цих клітин. після взаємодії з антигеном такі клітини отримують сигнал до секреції біологічно активних речовин (серотоніну, гістаміну), які відповідають за розвиток запального процесу та алергійної реакції / 0,0005 |
У біологічних об'єктах (сироватці крові, інших біологічних рідинах, тканинах) окремі класи імуноглобулінів утворюють надмолекулярні комплекси (n = 2 – 5). Основними класами імуноглобулінів крові людини, що реалізують гуморальну імунну відповідь на вторгнення чужорідного антигену, є імуноглобуліни G та М. Імуноглобуліни А відіграють роль антитіл у складі інших біологічних рідин та секретів, а імуноглобуліни класів D та Е є мінорними компонентами сироватки крові, що виконують додаткові спеціалізовані функції в комплексі імунних та алергічних реакцій.
12.8.2. Цитокіни. Існує значна кількість фізіологічно активних сполук, що синтезуються в імунній системі та відіграють роль міжклітинних хімічних сигналів, регулюють її активність та реалізують процеси міжклітинних комунікацій. Ці речовини отримали загальну назву цитокінів, або лімфокінів.
Цитокіни продукуються активованими лімфоцитами, макрофагами, лейкоцитами, іншими клітинами крові та сполучної тканини, які беруть участь у реакціях імунітету та неспецифічної резистентності організму в процесі запалення. Вони контролюють процеси дозрівання, функціонування та взаємодії між лімфоцитами та іншими клітинними ефекторами імунітету. Специфічними мішенями для лімфокінів є лімфоцити та макрофаги, що мають на своїй поверхні чутливі рецептори.
Гормональну внутрішньосистемну функцію виконує також загруднинна залоза (тимус), яка секретує біологічно активні субстанції (тимозини, тимопоетини. гимостимуліни тощо), що забезпечують дозрівання Т-лімфоцитів.
За хімічною природою медіатори та гормони імунної системи є білками, глікопротеїнами, низько- та високомолекулярними пептидами, які знаходяться в плазмі крові людини і здійснюють свої регуляторні функції в пікомолярних (10-12) концентраціях. Значна кількість речовин, що виконують функції лімфокінів, до цього часу недостатньо охарактеризовані як індивідуальні хімічні сполуки.
На сьогодні цитокіни прийнято поділяти на інтерлейкіни, інтерферони, фактори некрозу пухлин, колонієстимулівні та трансформувальніі фактори росту.
Інтерлейкіни (IL) – це група розчинних пептидів, які виконують функції імунорегуляторів локальної дії. На сьогодні виділено близько тридцяти окремих типів інтерлейкінів (ІL-1 – ІL-30), які різняться за структурою, фізико-хімічними властивостями та спектром біологічної активності (табл. 12.5).
Інтерферони (IFN) – група низькомолекулярних глікопротеїнів, які чинять противірусну дію та регулюють імунні реакції. Молекулярна маса IFN в межах 16 000 – 25 000 Да. Відомі 3 основні типи IFN: -IFN, -IFN та g-IFN. -IFN, -IFN, а також -IFN, -IFN та -IFN називають інтерферонами 1-го типу. До 2-го типу інтерферонів належить -IFN.
Фактори некрозу пухлин (TNF) – цитокіни, що регулюють імунну відповідь. Володіють цитотоксичними та цитостатичними властивостями, підсилюють кілінг пухлинних клітин, активують NK-клітини, що продукуються моноцитами-макрофагами. До TNF належать TNF-a і TNF-b.
За впливом на імунну систему поділяють на два типи:
Цитокіни, що регулюють клітинний імунітет (ІЛ-2, ІЛ-12, ІФН-γ, ФНП-α);
Цитокіни, що стимулюють переважно гуморальний імунітет і послаблюють клітинний (ІЛ-4, ІЛ-5, ІЛ-6, ІЛ-10 і ІЛ-13).
За біологічною дією цитокіни умовно поділяють на прозапальні (ІЛ-1, ІЛ-2, ІЛ-6, ІЛ-1β, ІЛ-12, ІФН-γ, ФНП-α) та антизапальні (ІЛ-4, ІЛ-10, ІЛ-13).
Таблиця 12.5. Класифікація та характеристика цитокінів
Цито-кін |
Місце ситезу |
Біологічна дія |
Інтерлейкіни (IL) |
||
IL-1
|
Стимульовані макрофаги, поліморфноядерні лейкоцити, епітеліальні клітини шкіри, трансформовані клітини хворих на лейкемію. |
Стимуляція проліферації Т-хелперів та індукція Т-хелперами секреції ІL-2; індукція експресії генів фосфоліпази А2 та циклооксигенази, що є біохімічною передумовою стимульованого синтезу в вогнищах запалення простагландинів і лейкотрієнів; стимуляція проліферації фібробластів, синтез білків гострої фази запалення в гепатоцитах, колагенази в синовіальних оболонках суглобів; індукція синтезу ІL-6, який значною мірою опосередковує дію ІL-1 на імунну є регуляцію. |
ІL-2 |
Макрофаги, фібробласти, активовані Т-хелпери |
Індукція диференціації Т-лімфоцитів до Т-кілерів, що вбивають пухлинні та інфіковані мікроорганізмами клітини; активація продукції -інтерферону; стимуляція продукції TNF-a Т- та NK-клітинами. |
ІL-3, (CSF) |
Активовані Т-хелпери, епітеліальні клітини тимусу |
стимуляція росту стовбурових гемопоетичних клітин – попередників лімфоцитів; сприяння проліферації плюрипотентних клітин-попередників |
ІL-4 |
Активовані Т-клітини, макрофаги, В-лімфоцити опасисті клітини та базофіли. |
участь у активації В-лімфоцитів; забезпечення перемикання синтезу ізотипів імуноглобулінів В-клітинами на синтез Ig; є чинником росту гладких клітин і бере участь у реакціях гіперчутливості негайного типу-4; участь в аутокриній і паракринній регуляції росту активованих Т-клітин. |
IL-5 |
Т-лімфоцити, опасисті клітини й еозинофіли. |
Контроль за проліферацію та дозріванням еозинофілів; регуляція передачі сигналу з Т- на В-лімфоцити, сприяння дозріванню антитілоутворювальних клітин. |
IL-6 |
Макрофаги, фібробласти, активовані Т-хелпери, клітини ендотелію, гепатоцити, нейрони |
Сприяння диференціюванню В-клітин; активація Т-клітини та гемопоетичних клітин-попередників; індукція дозрівання мегакаріоцитів (діє як тромбопоетин); основний індуктор реакцій гострої фази при запаленні; стимуляція продукування білків гострої фази гепатоцитами; фактор росту клітин мієломи та плазмоцитоми. |
|
Стовбурові клітини кісткового мозку, клітини загруднинної залози, селезінки |
Головний лімфопоетин В-клітин; сприяння росту тимоцитів і зрілих CD4+ і CD8+ клітин; |
IL-8 |
моноцити, нейтрофіли та NK-клітини |
Індукція гострої запальної реакції; участь у хемотаксисі нейтрофілів; стимуляція росту Т-лімфоцитів; модулювання синтезу IgE, IgD, В-лімфоцитами, активованими IL-4. |
IL-9 |
CD4+ Т-лімфоцити |
Дія на Т-хелпери, але не впливає на CD8+ цитотоксичні Т-лімфоцити; стимуляція росту опасистих клітин і еритроїдних попередників. |
IL-10, CSIF |
Моноцити, Т-хелпери (Th2), В-лімфоцити, макрофаги й опасисті клітини |
Інгібування продукції цитокинів Th1 лімфоцитами; пригнічення секреції інтерферону, синтез макрофагами факторів некрозу пухлин, IL-1, IL-3, IL-12; індукція росту Т-лімфоцитів і опасистих клітин; участь у синтезі IgA, інактиваціяє макрофагів. |
IL-11 |
Активовані фібробласти та стовбурові клітини кісткового мозку |
За механізмом дії практично аналогічний з IL-6, регулює попередники гемопоезу. |
IL-12 |
В-лімфоцити, моноцити, макрофаги |
Дія на В-клітини, NК-клітини та моноцити, індукуючи проліферацію та синтез цитокінів, особливо g-інтерферону; активація диференціювання Т-хелперів і Т-супресорів до зрілих цитотоксичних Т-лімфоцитів. |
IL-13 |
Th2-лімфоцити |
Вплив на синтез IgI; пригнічення функції мононуклеарних фагоцитів; інгібування синтезу протизапальних цитокінів моноцитами та макрофагами |
IL-14 |
Т-лімфоцити |
Фактор росту В-лімфоцитів; стимуляція росту і диференціювання активованих В-клітин; інгібування синтезу антитіл. |
IL-15 |
Моноцити й епітеліоцити |
Діє на активовані Т-, В- і NК-клітини, індукуючи їх проліферацію та диференціювання. |
IL-16 |
CD8+-Т-клітини |
Стимуляція міграції CD4+-Т-лімфоцитів, моноцитів, еозинофілів. |
IL-17 |
CD4+-Т-клітини |
Стимуляція продукування IL-6, IL-8, G-СSF |
IL-18 |
Макрофаги й остеобласти за участі Т- і В-лімфоцитів і NR-клітин |
Стимуляція секреції IFNg а також IL-2, GM-CSF – за допомогою Т-лімфоцитів, що призводить до активації цих клітин та інгібування продукування IgE |
Інтерферони (IFN) |
||
a-IFN |
В-лімфоцити, NK-клітини, моноцити і макрофаги |
Противірусна активність; півищує поверхневу експресію антигенів І класу головного комплекса гістосумісності на клітинах різних типів; протипухлинна активність; стимулює імунну цитотоксичність. |
-IFN |
Фібробласти, епітеліальні клітини, макрофагию |
аналогічно до a-IFN |
g-IFN |
Т-, В-лімфоцити, макрофаги |
Участь майже в усіх стадіях імунної відповіді та запальної реакції: вплив на диференціацію Th1 і В- клітин, активація цитотоксичних CD8+-Т-лімфоцитів, NK-клітин, макрофагів та нейтрофілів; противірусна й антипроліферативна активність |
Фактори некрозу пухлин (TNF) |
||
(a-TNF-кахексин |
Моноцити, макрофаги тощо |
Вплив на синтез цитокінів, головним чином через активування макрофагів; синергічна дія з епідермальним фактором росту та фактором росту тромбоцитів; стимуляція проліферації клітин ендотелію фібробластів, лімфоцитів; участь у запалених реакціях; індукція апоптозу пухлинних клітин; виявляє цитотоксичний ефект на інфіковані вірусами і паразитами клітининейтрофілів. |
b-TNF |
Лімфоцити |
Цитотоксичні властивості стосовно деяких клітин. |
Колонієстимулюючі фактори (КСФ) — цитокіни, що стимулюють ріст кровотворних клітин (гранулоцитів, моноцитів, попередників еритроїдних клітин). Вони продукуються Т-лімфоцитами, макрофагами, моноцитами, ендотеліальними клітинами.
Трансформуючі фактори росту (ТФР) — білки, що продукуються різними класами лімфоцитів, тромбоцитами, плацентою, деякими пухлинами. Вони стимулюють процеси проліферації фібробластів, синтезу колагену та фібронектину, беруть участь в ангіогенезі. загоюванні ран. Разом із цим, ТФР пригнічують проліферацію Т- та В-лімфоцитів, активність цитотоксичних та кіперних клітин.
Слід зазначити, що активовані лімфоцити та інші імунокомпетентні клітини синтезують пептидні фактори росту, зокрема епідермальний (ЕФР), нервовий (ФРН), а також соматомедини (інсуліноподібні фактори росту ІФР-1 та ІФР-2), і різні білково-поліпептидні гормони, що свідчить про надзвичайно важливу роль імунної системи в регуляції процесів росту, проліферації та клітинного диференціювання.
Введення цитокінів у організм підвищує кількість циркулюючих лейкоцитів і температуру тіла, зумовлює метаболічні зрушення та низку інших процесів. Лікарські препарати на основі цитокінів знайшли застосування в терапії низки захворювань (наприклад, у лікуванні хворих на злоякісні новоутворення, аплазію кровотворення, різноманітні видіи імунопатології). Так, наприклад, введення препарату ІL-2 при інфекційних захворюваннях відновлює здатність імунної системи адекватно здійснювати регуляторні та захисні функції (пероральне введення рекомбінантного інтерлейкіну-2 при гострих кишкових інфекціях і місцеве використання при хламідіозі та герпесі демонструє позитивні наслідки).
12.8.2.1. Молекулярні механізми противірусної дії інтерферонів. 1. Зв'язування інтерферонів із рецепторами клітин-мішеней. Інтерферони, які секретуються в зовнішньоклітинне середовище клітинами-продуцентами, взаємодіють із специфічними рецепторами на мембранах чутливих клітин, що є передумовою генерування хімічного сигналу та його трансмембранної передачі.
2. Активація внутрішньоклітинної 2’,5'-олігоаденілатсинтетази. Хімічний сигнал за допомогою внутрішньоклітинних месенджерів досягає геному зараженої вірусом клітини й індукує синтез ферменту, який утворює з молекул АТФ 2',5'-олігоаденілову кислоту (2',5'-оліго-А-синтетази). 2',5'-олігоаденілат є активатором РНКази І, яка розщеплює односпіральні вірусні РНК (мРНК) та рибосомальні РНК, що необхідні для трансляції вірусних білків.
3. Активація внутрішньоклітинних протеїнкіназ. Трансмембранний хімічний сигнал, генерований інтерфероном, спричиняє також активацію протеїнкінази, що фосфорилює білковий фактор ініціації трансляції IF-2. Фосфорилювання фактора ініціації IF-2 призводить до його інактивації та блоку рибосомального синтезу вірусних білків.
12.8.3. Біохімічні компоненти системи комплементу. Комплемент — ферментна система, необхідна для здійснення лізису чужорідних клітин (бактеріальних, тваринних) після їх взаємодії із специфічними антитілами. За біохімічною природою білки комплементу є каскадною системою протеаз, що послідовно активуються після утворення комплексу антиген-антитіло і спричиняють розщеплення мембранних структур клітин, які підлягають руйнуванню в процесі імунної реакції.
До складу системи комплементу входить понад 25 білків, з яких 9 – комплеметні білки (С1 – С9), а решта – фактори (B, D, P, H тощо). Субодиниця С1 складається з трьох білків: Clq, Cir, CIs. За фізіологічних умов білкові компоненти системи комплементу знаходяться в плазмі крові в неактивному стані, активування відбувається шляхом розщеплення молекул комплементних білків на фрагменти а (меншого розміру) і b (більший). Менший фрагмент, зазвичай, активний.
Активація системи комплементу реалізується за одним з механізмів — класичним або альтернативним (рис.12.16). За умов дії будь-якого з означених механізмів ключовим в активації системи комплементу є активація компоненту СЗ, який має автокаталітичні властивості, запускаючи каскад ферментативних реакцій за участі термінальних компонентів С7, C8 та C9. За відсутності активаторів відбувається його повільний розпад на С3a та С3b. Фрагмент С3b фіксується на поверхні мікроорганізму. За наявності активаторів, розщеплення С3 здійснюється значно швидше завдяки запуску систем активації комплементу класичним чи альтернативним шляхом.

Рис. 12.16. Схема механізмів активації системи комплементу
Класичний шлях активації комплементу — послідовність ферментативних реакцій, що запускається при взаємодії першого компонента комплементу С1 (фактор розпізнавання) з комплементзв'язуючими ділянками антитіл (IgG, IgM), які утворили комплекс антиген-антитіло на поверхні клітини. Для активації цього шляху необхідні два центри зв’язування першого компонента системи комплементу. Фіксація призводить до виникнення конформаційних змін молекули С1q і дає можливість фіксації С1r, що забезпечує фіксацію С1s. Всі ці зміни сприяють утворенню активного комплексу, який послідовно активує С4 і С2 компоненти комплементу. При цьому активація С4 компонента призводить до його розпаду з утворенням розчинних фрагментів С4а і С4b, які володіють естеразною активністю по відношенню до С2. В С4b з’являється ділянка, що дозволяє зв’язуватися з імунним комплексом і мембраною клітин, на якій активується система комплементу. Утворений С4b розщеплює С2 на С2а і С2b, а С2а, своєю чергою, приєднується до С4b. Комплекс С2а-С4b набуває властивостей С3-конвертази і розщеплює С3 компонент на С3а і С3b. С3b компонент, як було сказано вище, є ключовим для класичного й альтернативного шляхів активації комплементу. При розщепленні С3 відбувається формування мембраноатакуючого комплексу, який складається з білків С5-С9. Ці термінальні компоненти утворюють на поверхні клітинної мембрани надмолекулярний білковий комплекс, який розщеплює її білково-ліпідний бішар з утворенням канальців, що і спричинює остаточне руйнування клітини.
Активація системи комплементу альтернативним шляхом відбувається відразу після надходження антигену, в тому числі бактерій, вірусів, паразитів, пухлинних клітин, ліпополісахаридів. Вона розпочинається з С3-компонента комплементу без участі імуноглобулінів. необхідною за цих умов є участь білків пропердинової ситеми, представленої в сироватці крові білком пропердином, факторами D та В. У результаті низки біохімічних перетворень утворюється комплекс пропердину, С3 і фактора Активований фактор В (Вb) розщеплює основний компонент системи комплементу — С3, утворюючи С3-конвертазу - С3bBb, яка активує компонент С5, що відповідає за формування літичного мембранного комплексу.
Система комплементу бере участь не лише в імунній відповіді, їй також належить провідна роль у розвитку таких імунопатологічних реакцій, як набряк Квінке (C2b), анафілаксія (С3а), автоімунні захворювання. Таким чином, функції системи комплементу включають лізис клітин, розчинення імунних комплексів, участь у фагоцитозі та запальній реакції, утворення хемотаксинів, модулювання імунної відповіді, нейтралізація шкідливих речовин.
