
- •Основы современного естествознания введение
- •Раздел 1. Тематический план дисциплины
- •Раздел 2.
- •Краткий курс лекций
- •Лекция 1.
- •Естествознание в мировой культуре
- •1. Предмет, задачи, структура курса «Основы современного естествознания».
- •2. Естествознание в системе форм общественного сознания.
- •3. Философия, математика, гуманитарные и естественные науки и их объекты
- •4. Естественнонаучная и гуманитарная культуры. Специфика и взаимосвязь естественнонаучного и гуманитарного типов культур
- •5. Проблема постнеклассического межкультурного диалога естественных и гуманитарных наук
- •Лекция 2. Особенности физического описания реальности Современные представления о движении, пространстве и времени.
- •1. Идеальные образы объектов реального мира (твердое тело, материальная точка, частица, вакуум, среда, поле, вихрь, волна)
- •2. Физические характеристики идеальных объектов и представление о способах их описания ( масса; заряды и их действие на расстоянии; заряды как источники полей; «свободные» поля, суперпозиция полей)
- •3. Единицы физических величин
- •Лекция 3. Современные представления о движении, пространстве и времени
- •1. Движение и его виды. Относительность движения
- •2. Законы сохранения и их роль в формировании научной картины мира (законы сохранения энергии, импульса и момента импульса)
- •3. Пространство и время как основные свойства материи
- •Лекция 4. Понятие теплоты и термодинамический способ описания действительности
- •1. Термодинамические системы и их макроскопические храктеристики
- •2. Теплота и механическая работа (закон сохранения энергии)
- •3. Обратимые и необратимые процессы. Равновесное состояние и флуктуации. Закон возрастания энтропии
- •4. Неравновесные системы и их характеристики
- •Реакция Белоусова-Жаботинского
- •5. Бифуркации и аттракторы. Спонтанная самоорганизация в природе и обществе
- •Лекция 5. Квантовые представления о строении вещества и физическая Вселенная
- •1. Квантовые представления о строении вещества (фотоэффект и эффект Комптона, опыты по дифракции электронов и фотонов).
- •2. Современные представления о строении атома (волновые свойства атомов и молекул; лазерное излучение)
- •3. Соотношение неопределенностей и квантово-волновой дуализм
- •4. Представление об элементарных частицах и их взаимодействии. Ядерные взаимодействия. Атомная и термоядерная энергетика
- •5. Квантовая инженерия в наномире
- •Лекция 6. Элементарные частицы и физический эксперимент
- •1. Современные ускорители
- •2. Рождение и аннигиляция элементарных частиц
- •3. Виды взаимодействий элементарных частиц
- •4. Теория кварков
- •Лекция 7. Элементы современной космологии (физическая Вселенная)
- •1. Космические объекты и методы их исследования
- •2. Солнечная система в мире галактик
- •3. Модель Большого взрыва
- •4. Звезды и их эволюция
- •5. Земля в свете антропного принципа
- •Геохронологическая и стратиграфическая шкалы
- •Географическая оболочка Земли
- •Лекция 8. Система современного химического знания
- •1. Химия как наука, современная химическая картина мира (структурные уровни организации материи с точки зрения химии).
- •2. Основные понятия и законы химии (периодический закон и его значение)
- •3. Классификация химических веществ
- •§ 2. Теория строения органических соединений
- •§ 3. Классификация органических соединений
- •§ 4. Высокомолекулярные соединения (полимеры)
- •4. Теория химического строения вещества. Взаимосвязь между строением, свойствами и реакционной способностью вещества
- •Лекция 9. Растворы. Химическая идентификация
- •1. Растворы и их особенности
- •2. Химическая идентификация
- •3. Химические процессы (реакции)
- •4. Химия экстремальных состояний
- •Лекция 10. Современная химия: экономический и социальный аспекты
- •1. Масштабы современного химического производства
- •2. Проблемы сырьевых ресурсов и химия
- •Металлы и их коррозия
- •3. Химические процессы и материалы (традиционные материалы - дерево, стекло, керамика; применение металлов и сплавов, силикатных материалов, полимеров, биологически активных веществ)
- •6.11. Традиционные материалы с новыми свойствами
- •Синтетические материалы.
- •4. Материалы для создания носителей информации. Химия и нанотехнологии
- •5. Химико-энергетические процессы в природе и технике (альтернативные виды топлива, «зеленая химия»)
- •Аккумуляторы для сотовых телефонов. Эффект памяти
- •А теперь подведем итоги.
- •Лекция 11. Роль химии в современном обществе
- •1. Экологические и социальные аспекты химии
- •2. Проблема переработки вторичных ресурсов
- •3. Химия и окружающая среда
- •4. Защита биосферы от химических загрязнений
- •5. Роль химии в решении проблем устойчивого развития цивилизации
- •Лекция 12. Особенности современного биологического знания и его эволюция
- •1. Биология как наука и особенности биологического познания мира
- •2. Фундаментальные и частные биологические теории
- •3. Традиционный, физико-химический, эволюционный и биоинженерный периоды развития биологии. Основные достижения биологии в эти периоды
- •4. Генетическая революция в биологии
- •5. Синергетическая теория эволюции (глобальная эволюция)
- •6. Этические проблемы современной биологии
- •Лекция 13. Современные концепции происхождения и сущности жизни
- •1. Феномен жизни и его исследование
- •2. Отличительные особенности живой и неживой материи
- •3. Основные концепции происхождения жизни
- •5. Идея трансформации биосферы в ноосферу и глобальный эволюционизм
- •Лекция 14. Концепция структурных уровней организации живой материи
- •1. Уровни организации живой природы: молекулярно-генетический, онтогенетический, надорганизменный (популяционно-видовой), популяционно-биоценотический (биогеоценотический)
- •2. Биосферный уровень организации живой материи
- •3. В.И. Вернадский о роли «живого вещества»
- •4. Материальные основы появления жизни на Земле
- •Концепция происхождения живого по гипотезе Опарина-Холдейна
- •5. Возникновение и роль многоклеточных организмов в формировании биосферы Земли Лекция 15. Человек, его место и роль в едином социоприродном комплексе
- •1. Человек как единство биологического, социального и духовного. Генезис человека
- •2. Факторы, закономерности и этапы антропосоциогенеза
- •3. Культура как фактор регуляции (агрессии) человека
- •4. Социобиология и проблема геннокультурной коэволюции
- •5. Биологические предпосылки возникновения социальности человека. Роль социальных факторов в становлении человека
- •4. Перспективы исследования космобиосоциальной сущности человека в современной биологии
- •Биокатализ
- •Генные технологии
- •8 8. Проблемы клонирования
- •2. Достижения и возможные негативные последствия биотехнологий
- •3. Поиск путей развития общества, сохраняющих целостность природы Глава 11 гармония трудовой деятельности людей и природы
- •11.1. Обновление энергосистем
- •11.2. Промышленность, автотранспорт и окружающая среда
- •11.3. Города и природа
- •11.4. Решение проблем утилизации
- •11.5. Перспективные материалы, технологии и окружающая среда
- •4. Ресурсы биосферы и демографические проблемы
- •Лекция 17. Социальное измерение современного естествознания
- •1. Роль научного знания на современном этапе развития общества
- •2. Нелинейное освоение культурой результатов научной деятельности
- •3. Наука и сми
- •5.4. Экологические проблемы сегодня
- •4. Естествознание как основа современных технологий
- •5. Проблема моделирования социокультурных явлений
- •Раздел 3.
- •Семинар 2 . Взаимодействие естественнонаучного и гуманитарного знания
- •Семинар 4. Концепции термодинамики
- •Семинар 5 . Квантовые представления о строении вещества и физическая Вселенная
- •Семинар 6 . Элементарные частицы и физический эксперимент
- •Семинар 7 . Элементы современной космологии (физическая вселенная)
- •Раздел 2. Химия в контексте устойчивого развития общества Семинар 8. Система современного химического знания
- •Семинар 9 . Растворы. Химическая идентификация
- •Семинар 10. Современная химия: экономический и социальный аспекты
- •Семинар 11. Роль химии в современном обществе
- •Раздел 3. Специфика, структура и проблемное поле современного биологического познания Семинар 12 . Особенности современного биологического знания и его эволюции
- •Семинар 13 . Современные концепции происхождения и сущности жизни
- •Семинар 14. Концепция структурных уровней организации живой материи
- •Семинар 15. Человек, его место и роль в едином социоприродном комплексе
- •Семинар 16 . Социальный аспект биологического познания
- •Заключение. Социальное измерение современного естествознания Семинар 17. Перспективы развития естествознания и гуманитарных наук в 21 веке
- •3.2. Перечень вопросов к экзамену (зачету)
- •3.3. Учебно-методические материалы по дисциплине
4. Неравновесные системы и их характеристики
Первый закон термодинамики не устанавливает направление тепловых процессов. Однако, как показывает опыт, многие тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Обратимыми процессами называют процессы перехода системы из одного равновесного состояния в другое, которые можно провести в обратном направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.
Процессы, в ходе которых система все время остается в состоянии равновесия, называются квазистатическими. Все квазистатические процессы обратимы. Все обратимые процессы являются квазистатическими.
Если рабочее тело тепловой машины приводится в контакт с тепловым резервуаром, температура которого в процессе теплообмена остается неизменной, то единственным обратимым процессом будет изотермический квазистатический процесс, протекающий при бесконечно малой разнице температур рабочего тела и резервуара. При наличии двух тепловых резервуаров с разными температурами обратимым путем можно провести процессы на двух изотермических участках. Поскольку адиабатический процесс также можно проводить в обоих направлениях (адиабатическое сжатие и адиабатическое расширение), то круговой процесс, состоящий из двух изотерм и двух адиабат (цикл Карно) является единственным обратимым круговым процессом, при котором рабочее тело приводится в тепловой контакт только с двумя тепловыми резервуарами. Все остальные круговые процессы, проводимые с двумя тепловыми резервуарами, необратимы.
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из-за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам. Обратимые процессы являются идеализацией реальных процессов.
Первый закон термодинамики не может отличить обратимые процессы от необратимых. Он просто требует от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет. Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Английский физик У. Кельвин дал в 1851 г. следующую формулировку второго закона:
В циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Гипотетическую тепловую машину, в которой мог бы происходить такой процесс, называют «вечным двигателем второго рода». В земных условиях такая машина могла бы отбирать тепловую энергию, например, у Мирового океана и полностью превращать ее в работу. Масса воды в Мировом океане составляет примерно 1021 кг, и при ее охлаждении на один градус выделилось бы огромное количество энергии (≈1024 Дж), эквивалентное полному сжиганию 1017 кг угля. Ежегодно вырабатываемая на Земле энергия приблизительно в 104 раз меньше. Поэтому «вечный двигатель второго рода» был бы для человечества не менее привлекателен, чем «вечный двигатель первого рода», запрещенный первым законом термодинамики.
Немецкий физик Р. Клаузиус дал другую формулировку второго закона термодинамики:
Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой.
Второй закон термодинамики связан непосредственно с необратимостью реальных тепловых процессов. Энергия теплового движения молекул качественно отличается от всех других видов энергии – механической, электрической, химической и т. д. Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, то есть он не может быть осуществлен полностью в обратном направлении.
Но классическая термодинамика не знакома со временем и пространством: она признает только такие понятия, как покой (равновесие), для которого не существует времени, и однородность, для которой безразлична протяженность в пространстве. Этот недостаток особенно ощутим для инженера, сильно стесненного рамками времени и пространства. Чтобы справиться с указанной трудностью, Онзагером (Л. Онзагер (1903 - 1976) - американский химик и физик, профессор химии ряда американских университетов. В 1931 г. доказал ряд теорем термодинамики необратимых процесaсов) была предложена термодинамика необратимых процессов, уже содержавшая и время, и пространство, и эффекты выделения теплоты трения в необратимых (неравновесных) процессах. Это был революционный шаг принципиальной важности. Однако теория Онзагера по-прежнему имеет в своей основе второй закон классической термодинамики, с помощью которого вводится понятие энтропии, справедливой только для состояния равновесия. Поэтому, строго говоря, применение термодинамики Онзагера ограничивается лишь процессами, бесконечно мало отклоняющимися от состояний равновесия. Это направление получило широкое развитие, особенно в рамках нидерландско-бельгийской школы; термодинамика необратимых процессов стала именоваться термодинамикой неравновесных процессов, но фундамент ее не претерпел, изменений.
Неравновесная термодинамика открытых систем изучает существенно неравновесные процессы. В их описании ключевую роль играет понятие возрастания энтропии системы за счет процессов, происходящих внутри нее. Такой подход привел к новому взгляду на привычные понятия. Выдающаяся роль в развитии данного научного направления принадлежит И.Р. Пригожину, удостоенному за свои работы Нобелевской премии в 1977 году. Большой вклад внесли также Л.Берталанфи, Л.Онзагер, Л.И.Мандельштам, М.А.Леонтович, М.Эйген, Г.Хакен. Открытые системы, в которых наблюдается прирост энтропии, получили название диссипативных. В таких системах энергия упорядоченного движения переходит в энергию неупорядоченного хаотического движения, т.е. в тепло. Если замкнутую систему вывести из состояния равновесия, то в ней начнутся процессы, возвращающие ее к состоянию термодинамического равновесия, в котором ее энтропия достигает максимального значения. Со временем степень неравновесности будет уменьшаться, однако, в любой момент времени ситуация будет неравновесной. В случае открытых систем отток энтропии наружу может уравновесить ее рост в самой системе. В этих условиях может возникнуть и поддерживаться стационарное состояние. Такое состояние Берталанфи назвал текущим равновесием. По своим характеристикам текущее равновесие может быть близко к равновесным состояниям. В этом случае производство энтропии минимально (теорема Пригожина). Если же отток энтропии превышает ее внутреннее производство, то возникают и разрастаются до макроскопического уровня крупномасштабные флуктуации. При определенных условиях в системе начинает происходить самоорганизация - создание упорядоченных структур из хаоса. Эти структуры могут последовательно переходить во все более сложные состояния. Такие образования в диссипативных системах Пригожин назвал диссипативными структурами.
Благодаря сложности открытых систем в них возможно образование различного рода структур. При этом вся диссипация играет при образовании структур конструктивную роль. Это кажется, на первый взгляд, удивительным, так как понятие диссипации ассоциируется с затуханием различного рода движений, с рассеянием энергии, с потерей информации. Однако, и это чрезвычайно существенно, диссипация необходима для образования структур в открытых системах.
Чтобы подчеркнуть это обстоятельство, Илья Пригожин ввел термин "диссипативные структуры". Это чрезвычайно емкое и точное название объединяет все виды структур: временные, например автоколебания в генераторе, пространственные, например ячейки Бенара на поверхности жидкости, и, наконец, наиболее общие пространственно-временные структуры. Примером последних могут служить автоволны на поверхности жидкости.
Сложность открытых систем предоставляет широкие возможности для существования в них коллективных явлений. Чтобы подчеркнуть роль коллектива, роль кооперации при образовании диссипативных структур, Герман Хакен ввел термин синергетика, что означает совместное действие.
Синергетика – не самостоятельная научная дисциплина, но новое междисциплинарное научное направление; цель синергетики - выявление общих идей, общих методов и общих закономерностей в самых разных областях естествознания, а также социологии и даже лингвистики; более того, в рамках синергетики происходит кооперирование различных специальных дисциплин. Синергетика родилась на базе термодинамики и статистической физики.
Хаос и порядок - понятия, которые играли существенную роль уже в мировоззрении философов древности. Не вдаваясь в детали, отметим лишь сформулированные ими положения, которые сохраняют свое значение и по сей день. По представлениям Платона и его учеников, хаос - состояние материи, которое остается по мере устранения возможностей проявления ее свойств. С другой стороны, из хаоса возникает все, что составляет содержание мироздания, то есть из хаоса может рождаться порядок. В физике понятия "хаос" и "хаотическое движение" являются фундаментальными, но все же недостаточно четко определенными. Действительно, согласно Больцману, наиболее хаотическим является движение в состоянии равновесия. Хаотическими, однако, называют и движения, далекие от равновесного. Это, например, "движения" в генераторах шума, предназначенных для подавления сигналов.
Хаотическими называют, как правило, и различного рода турбулентные движения в газах и жидкостях. Примером служит турбулентное движение в трубах. Оно возникает из ламинарного движения при достаточно большом перепаде давления на концах трубы. При этом представление о турбулентном движении как более хаотичном, чем ламинарное, кажется само собой разумеющимся. Такой вывод основан, однако, на смешении понятий сложности и хаотичности. При наблюдении турбулентного движения проявляется именно сложность движения. Вопрос же о степени хаотичности требует дополнительного анализа, и для количественных оценок необходимы соответствующие критерии.
В последние годы стало широко использоваться понятие "динамический хаос" для характеристики сложных движений в сравнительно простых динамических системах. Слово "динамический" означает, что отсутствуют источники флуктуаций - источники беспорядка. По этой причине понятие "динамическая система" отвечает определенной идеализации. Более реальное хаотическое движение с учетом и случайных источников можно назвать "физический хаос". Его примером и является хаотическое движение атомов и молекул в состоянии равновесия.
Первый пример динамического хаоса был обнаружен в работе Эдварда Лоренца в 1963 году. Он исследовал решение уравнений, которые служат математической моделью конвективного движения в газах и жидкостях. Конвективное движение возникает благодаря совместному действию поля тяжести и градиента температуры, создаваемого внешним источником тепла. Речь идет, таким образом, об открытой системе. Представим себе слой жидкости, который подогревается снизу. Конвективное движение выражается в том, что более нагретые элементы жидкости перемещаются вверх, а более холодные - вниз. Происходит тем самым передача тепла снизу вверх. При достаточно малых градиентах температуры перенос тепла определяется за счет теплопроводности. Это молекулярный – неорганизованный – процесс. Он не сопровождается упорядоченным гидродинамическим движением, которое могло бы, подобно регулировке уличного движения, управлять переносом тепла. Ситуация существенно меняется, когда градиент температуры превышает некоторое критическое значение. Изменение проявляется в том, что в жидкости возникает упорядоченное макроскопическое движение. Оно и называется конвективным. В результате происходит саморегулировка теплового потока: внутри ячеек более теплая жидкость поднимается вверх, а по краям более холодная опускается вниз. Таким образом, распределение встречных тепловых потоков становится c упорядоченным.
Эта ситуация напоминает регулировку встречных потоков при уличном движении. Есть, однако, и существенная разница. Действительно, регулировка уличного движения регламентируется правилами уличного движения. При конвективном же движении имеет место процесс самоорганизации. Задается лишь градиент температуры. Перестройка же движения происходит благодаря внутренним свойствам самой системы. Внешне результат этой перестройки проявляется в том, что на поверхности жидкости появляется диссипативная пространственная структура – ячейки Бенара. Благодаря такой перестройке обеспечивается большая пропускная способность, чем при молекулярном – неупорядоченном – теплопереносе. Появление новой структуры можно рассматривать как неравновесный фазовый переход.
Другим примером неравновесного фазового перехода может служить возникновение когерентного электромагнитного излучения в квантовых оптических генераторах – лазерах.
Отметим условия, необходимые для возникновения неравновесных фазовых переходов, которые выражаются в образовании новых диссипативных структур.
Диссипативные структуры могут образовываться только в открытых системах. Только в них возможен приток энергии, компенсирующий потери за счет диссипации и обеспечивающий существование более упорядоченных состояний.
Диссипативные структуры возникают в макроскопических системах, то есть в системах, состоящих из большого числа элементов (атомов, молекул, макромолекул, клеток и т.д.). Благодаря этому возможны коллективные – синергетические взаимодействия, необходимые для перестройки системы.
Диссипативные структуры возникают лишь в системах, описываемых нелинейными уравнениями для макроскопических функций. Примерами могут служить кинетические уравнения, например уравнение Больцмана, уравнения газовой динамики и гидродинамики, уравнения Максвелла в электродинамике для напряженностей электромагнитного поля и т.д.
Для возникновения диссипативных структур нелинейные уравнения должны при определенных значениях управляющих параметров допускать изменение симметрии решения. Такое изменение выражается, например, в переходе от молекулярного теплопереноса к конвективному теплопереносу по ячейкам Бенара.
Неравновесные фазовые переходы гораздо разнообразней, чем равновесные. Они играют существенную роль не только в физических, но и в химических и биологических процессах. Все больше осознается роль неравновесных фазовых переходов и в социальных системах, и в экономике.
Рассмотрим математическую модель, которая была использована в работе Лоренца для описания конвективного движения в атмосфере с целью предсказания погоды.
Конвективное движение в атмосфере описывается весьма сложными уравнениями газовой динамики. Они служат примером уравнений механики сплошной среды. Для математического моделирования этого движения Лоренц использовал весьма упрощенную модель - систему трех обыкновенных, но нелинейных дифференциальных уравнений. Они представляют собой динамические уравнения для макроскопических характеристик среды - компонент Фурье локальной скорости и температуры. Их решение может быть проведено лишь численно, с помощью компьютеров. Проведенный анализ показал, что при достаточно больших значениях градиента температуры поведение решения является настолько сложным, что соответствующие движения воспринимаются как хаотические. Это и дало основание ввести новое понятие "динамический хаос".
Более того, было установлено, что малейшее изменение начальных условий радикально меняет характер движения. Тем самым движение оказывается динамически неустойчивым. Поскольку начальные условия могут быть заданы лишь с конечной точностью, то предсказание вида движения по заданным начальным условиям становится практически невозможным. Таким образом, из-за наличия динамической неустойчивости движения в атмосфере задача долгосрочного прогноза погоды становится чрезвычайно трудной.
Производство и поток энтропии. Рассмотрим теперь поведение открытых систем, которые обмениваются с окружающей средой и веществом и энергией. Изменение энтропии такой системы складывается из внутренних изменений diS энтропии и ее притоком или оттоком в систему deS из-за теплообмена с окружающей средой и в результате обмена веществом. Следовательно, общее изменение энтропии открытой системы dS равно dS=diS+deS (1)
Покажем, что знак
производства энтропии diS
![]() 0.
Для этого окружим систему адиабатической*
оболочкой, тогда прекратится приток
или отток вещества и энергии, т. е. deS=0.
Согласно второму началу термодинамики
dS
0,
формула (1) для такой системы примет вид
dS = diS
0,
т. е. diS
всегда больше или равна нулю.
0.
Для этого окружим систему адиабатической*
оболочкой, тогда прекратится приток
или отток вещества и энергии, т. е. deS=0.
Согласно второму началу термодинамики
dS
0,
формула (1) для такой системы примет вид
dS = diS
0,
т. е. diS
всегда больше или равна нулю.
Знак deS может быть как положителен, так и отрицателен в зависимости от конкретных условий, т. е. приток энтропии может быть больше или меньше ее оттока. Поэтому согласно формуле (1) изменение энтропии в открытой системе может быть как больше, так и меньше нуля.
Рассмотрим возможные ситуации:
-
deS > 0, diS 0 всегда, dS>0;
deS < 0, но |deS| < diS, dS > 0 ;
deS < 0, но |deS| > diS, dS < 0 ;
deS < 0, но |deS| = diS, dS = 0.
Следует обратить внимание на два последних случая: в открытой системе возможно состояние, когда энтропия не изменяется или даже уменьшается, т. е. показана принципиальная возможность самопроизвольного движения от хаоса к порядку. Этот вывод принципиально нов и открывает интересные перспективы в исследовании.
Пусть в системе нет производства энтропии, т. е. diS = 0, а имеется лишь поток теплоты, тогда
![]() ,
,
но этот поток может быть направлен как в систему, так и из системы, т. е. deS может быть как больше нуля, так и меньше нуля.
При одновременном производстве энтропии формула (1) примет вид
![]() .
.
Второе начало термодинамики учит нас, что все естественные процессы сопровождаются возрастанием энтропии. Если рассматривать два процесса (производство энтропии и поток энтропии) в открытой системе при наличии связи между процессами, то возможен, как мы видели, противоестественный ход dS < 0. Простая иллюстрация этого принципа приведена на рисунке.
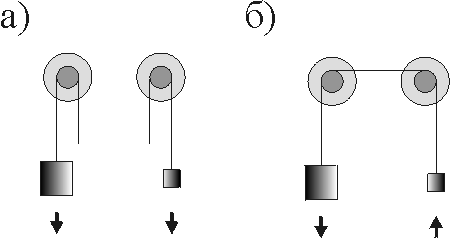
Рис.1.Два груза: а) - не связанные б) - связанные между собой
Два груза, не связанные между собой, стремятся упасть вниз (а); однако, если они соединены шкивом, то более легкий из них будет подниматься за счет тяжелого (б). Это своего рода механический аналог рассматриваемого явления о "противоестественном" течении процесса.
Конвективные ячейки Бенара.
В 1901 году физик Бенар обнаружил странный эффект в конвективном движении газа и жидкости. Рассмотрим слой жидкости, подогреваемой снизу. Тепло переносится в результате процесса теплопроводности, т. е. благодаря молекулярной передаче энергии хаотически движущихся молекул газа или жидкости.
Эффект Бенара
можно также наблюдать в следующем опыте:
в неглубокий сосуд помещают растительное
или силиконовое масло и равномерно
подогревают его снизу. Возникает разность
температур между верхней и нижней
поверхностями. При
![]() T
>
Tкр
возникает конвекция и жидкость разбивается
на гексагональные ячейки (рис. 2), т. е.
возникает динамическая, организованная,
упорядоченная структура - это один из
видов диссипативной структуры.
T
>
Tкр
возникает конвекция и жидкость разбивается
на гексагональные ячейки (рис. 2), т. е.
возникает динамическая, организованная,
упорядоченная структура - это один из
видов диссипативной структуры.
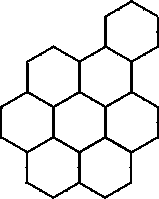
Рис. 2. Ячейки Бенара в сосуде с вязкой жидкостью.
