- •Бийский технологический институт (филиал)
- •И.В. Боткин, ю.Н. Косицын, п.И. Мазуров
- •Лабораторная работа №1 (4 часа)
- •Изучение процесса кристаллизации.
- •Затвердевание капли раствора азотнокислого свинца
- •1 Цель работы
- •2 Предмет и содержание работы
- •2.1 Кристаллическое строение металлов и сплавов
- •2.2 Первичная кристаллизация металла
- •2.3 Кристаллизация и строение металлического слитка
- •3 Оборудование, технические средства, инструмент
- •3. 1 Изучение устройства и работы микроскопа amplival
- •4 Порядок выполнения работы
- •4.1 Изучение процесса кристаллизации раствора азотнокислого свинца
- •5 Общие правила к оформлению работы
- •6 Контрольные вопросы
- •7 Задания
- •8 Список использованных источников
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию Российской Федерации
Государственное образовательное учреждение высшего профессионального образования «Алтайский государственный технический университет имени И.И. Ползунова»
Бийский технологический институт (филиал)
И.В. Боткин, ю.Н. Косицын, п.И. Мазуров
Лабораторная работа №1 (4 часа)
Изучение процесса кристаллизации.
Затвердевание капли раствора азотнокислого свинца
Методические указания к лабораторной работе
Бийск 2009
УДК
Боткин И.В. Изучение процесса кристаллизации. Затвердевание капли раствора азотнокислого свинца: Методические указания к лабораторной работе для студентов специальностей 151001, 190603, 170104, 240701, 240702, 240706, 160302, 220501, 260601 /И.В. Боткин, Ю.Н. Косицын, П.И. Мазуров.
Алт. гос. тех. ун-т, БТИ, - Бийск
Из-во Алт. гос. техн. ун-та, 2009. - 25с.
Методические указания предназначены для студентов, изучающих курс «Материаловедение».
В указаниях изложены сведения об атомно-кристаллической структуре металла, сущности процесса кристаллизации и кристаллического строения стального слитка, приводится методика использования биологического микроскопа при изучении процесса кристаллизации на примере затвердевания капли раствора азотнокислого свинца.
Рассмотрены и одобрены на заседании кафедры «Металлорежущие станки и инструменты».
Протокол № ___от «___» «________________» 200_ г.
Рецензент: д.т.н., начальник отдела ФГУП «ФНПЦ «Алтай» Игонин Г.С.
©БТИ АлтГТУ, 2009
1 Цель работы
Данная работа предполагает:
закрепление, углубление и расширение знаний студентов об атомно-кристаллической структуре металла, сущности процесса кристаллизации и кристаллического строения стального слитка;
приобретение умений и навыков использования технических средств (биологический микроскоп) при изучении процесса кристаллизации на примере затвердевания капли раствора азотнокислого свинца.
2 Предмет и содержание работы
2.1 Кристаллическое строение металлов и сплавов
Металлы обладают ярко выраженными специфическими свойствами: высокой электро- и теплопроводностью, непрозрачностью, металлическим блеском, сочетанием высокой прочности и пластичности. Характерным свойством металлов является увеличение их электросопротивления с повышением температуры. Все специфические свойства металлов обусловлены атомным строением и типом связи между атомами.
Для металла характерно наличие атомно-кристаллической структуры, под которой понимают взаимное расположение атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях.
Типичным атомным строением металлов является наличие малого количества валентных электронов на внешней электронной оболочке. Валентные электроны слабо связаны с ядром, поэтому под воздействием внешних сил при затрате сравнительно небольшой энергии они могут покинуть свои орбиты. Чем меньше электронов находится на внешней оболочке, тем меньше необходимо затратить энергии для полного освобождения электрона от связи с ядром атома.
У большинства элементов периодической таблицы заполнение электронами новой квантовой оболочки начинается только после того, как полностью заполнится предыдущая квантовая оболочка. Однако, в таблице Д. И. Менделеева имеется группа элементов, у которых на наружной квантовой оболочке имеется 1…2 электрона при не полностью заполненной электронами внутренней квантовой оболочке. Такие элементы называются переходными металлами. К ним относятся титан, ванадий, хром, марганец, железо, кобальт, никель и др. Их свойства, такие как парамагнетизм, ферромагнетизм (железа, кобальта, никеля), способность образовывать соединения с углеродом (карбиды) и др., существенно зависят от степени заполнения электронами внутренних квантовых оболочек.
Одним из основополагающих моментов в процессе кристаллизации является тип существующей межатомной связи.
При сближении изолированных атомов внешние электронные оболочки начинают перекрываться и взаимодействовать между собой, в результате чего они изменяют свое строение. В зависимости от характера изменения строения валентных электронных оболочек различают четыре основных типа связи между атомами: ионную (гетерополярную), ковалентную (гомеополярную), полярную (связь Ван-дер-Ваальса) и металлическую.
Характерной особенностью ионной, ковалентной и полярной связей является наличие направленных сил связи между отдельными атомами. При направленной связи каждый атом объединяется только с определенными атомами.
Металлический тип связи осуществляется между атомами (в жидких и твердых металлах), когда число валентных электронов в атоме мало. В этом случае свободных электронных оболочек имеется значительно больше, чем электронов для их заполнения. Поэтому при перекрытии внешних электронных оболочек электроны отрываются от своих атомов и свободно перемещаются в различных направлениях по незанятым электронным оболочкам между положительно ионизированными атомами (ионами), образуя вокруг них свободный, так называемый, электронный газ. Между положительными ионами и свободным электронным газом возникают силы электростатического взаимопритяжения, которые и обуславливают металлический тип связи между атомами.
В отличие от других межатомных связей металлический тип характеризуется отсутствием направленных сил связи между атомами. Поэтому смещение атомов друг относительно друга под воздействием внешних сил не приводит к уничтожению межатомных сил связи, так как наличие свободного электронного газа обеспечивает межатомную связь и в новом положении атомов. Следовательно, отсутствием направленных связей между атомами объясняется высокая пластичность металлов и металлических сплавов.
При наличии направленных сил связей смещение атомов друг относительно друга под воздействием внешних сил приводит к уничтожению связи между атомами, т.е. к разрушению без пластической деформации. Наличие свободных электронов и электронных оболочек обуславливает также высокую электротеплопроводность металлов и металлических сплавов.
Все металлы и металлические сплавы являются телами кристаллическими. В отличие от аморфных тел в кристаллическом теле атомы (также положительные ионы) располагаются в строго определенном порядке и в пространстве образуют так называемую кристаллическую решетку. Атомы в кристаллической решетке стремятся расположиться по возможности плотнее (ближе) друг к другу. Каждый атом в кристаллической решетке находится в одинаковом окружении, т.е. имеет вокруг себя одинаковое количество атомов, находящихся на равном расстоянии.
Металлический тип связи, отсутствие направленных связей между атомами и возможность каждого атома в кристаллической решетке находиться в тесном контакте со всеми окружающими его ближайшими соседними атомами позволяют у металлов получать наиболее плотное расположение атомов в кристаллической решетке. Переход электронов от одного атома к другому осуществляется тем реже, чем плотнее атомы прилегают друг к другу.
Согласно электронной теории строения металлов отметим, что различные составляющие энергии кристалла, связанного силами металлической связи, можно записать в виде выражения:
|
(1) |
где атомный объем (объем, приходящийся на один атом).
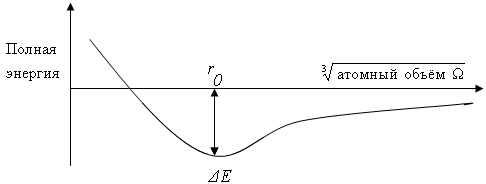
Первый член этого выражения представляет собой потенциальную энергию свободных электронов, второй член их кинетическую энергию, а третий член кинетическую энергию электронов, занимающих более низкие энергетические состояния. Сумма этих трех составляющих дает результирующую кривую распределения энергии, представленную на рисунке 1, где минимум энергии соответствует линейному размеру ro, который можно рассматривать как атомный радиус, соответствующий следующему равенству: (4/3)ro3 = .
Энергия Е представляет собой работу, необходимую для того, чтобы перевести металлический кристалл в газ из положительно заряженных ионов.
Металлический тип связи, возникающий между положительно заряженными ионами и валентными (отрицательно заряженными) электронами, обуславливает появление сил, удерживающих атомы (ионы, молекулы) в узлах кристаллической решетки на определенном расстоянии друг от друга. Эти силы складываются из сил притяжения и отталкивания. Равновесному состоянию соответствует такое состояние, когда суммарная энергия взаимодействия сил притяжения и отталкивания является минимальной. В этом случае расстояние между атомами (ионами) одинаково и атомы располагаются закономерно, образуя правильную кристаллическую решетку/
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие твердое кристаллическое тело, в данном случае металл. Наименьший объём кристалла, дающий представление об атомной структуре металла во всем объёме, получил название элементарной кристаллической решетки (ячейки). Другими словами, под элементарной кристаллической решеткой подразумевается комплекс атомов, который при своем многократном повторении в пространстве позволяет воспроизводить пространственную кристаллическую решётку.
|
Рисунок 1 – Зависимость полной энергии металла от межатомного расстояния |
Метод изображения кристаллической решетки в виде различных многогранников является условным. Более правильным является представление атомов в кристаллической решетке в виде соприкасающихся шаров, рисунок 2.
Строение и свойства кристаллических решеток характеризуется следующими параметрами:
периодом решетки «а». Периодом решетки называется расстояние между центрами соседних атомов, находящихся в узлах кристаллической решетки. Период решетки принято измерять в ангстремах или нанометрах (1 нм = 10-9 см = 0,1
 );
);координационным числом, показывающим, сколько атомов находится на наиболее близком и равном расстоянии от любого выбранного атома. Координационное число характеризует взаимную связь атомов друг от друга;
базисом кристаллической решетки, то есть числом атомов, приходящихся на одну элементарную ячейку. Базис характеризует плотность решетки.
|
|
а |
б |
|
|
в |
|
а объемно-центрированная кубическая (о.ц.к); б гранецентрированная кубическая (г.ц.к); в гексагональная плотноупакованная (г.п.у). |
|
Рисунок 2 – Элементарные кристаллические решетки металлов и схемы упаковки атомов. |
|
В каждой решетке, кроме объема, занимаемого атомами, остается еще свободное пространство (пустота). Отношение объема, занимаемого атомами, ко всему объему решетки называется коэффициентом компактности. Чем больше коэффициент компактности, тем теснее уложены атомы в решетке (больше плотность) и тем легче будет осуществляться связь в решетке между атомами, то есть легче осуществляется переход валентных электронов от одного атома к другому.
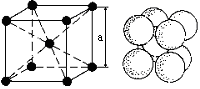
Большинство металлов и сплавов кристаллизуется с образованием одной из следующих элементарных кристаллических решеток:: объёмно-центрированной кубической, гранецентрированной кубической и гексагональной плотноупакованной, рисунок 2.
Кубическая
объёмно-центрированная решётка (К8), с
координационным числом 8 и базисом,
равным двум атомам. В ней каждый атом,
находящийся в вершине куба, принадлежит
одновременно 8 ячейкам. Атом, находящийся
внутри кристаллической решётки,
принадлежит только одной элементарной
ячейке. Таким образом, только (1/8)8+1=2
атома на каждую объемно-центрированную
решетку. Кубическая решетка определяется
одним периодом
длиной ребра куба «а», которая колеблется
от 2,68 до 6,07
.
Наименьшее расстояние между атомами,
выраженное через период решетки «а»,
равно
![]() .
Коэффициент компактности 0,68 или 68 .
Решетку К8 имеют металлы: Feα; Mo; W;
V; Cr; Nb; Ti; Ta;
Li; Na и др.
.
Коэффициент компактности 0,68 или 68 .
Решетку К8 имеют металлы: Feα; Mo; W;
V; Cr; Nb; Ti; Ta;
Li; Na и др.
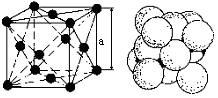
Кубическая
гранецентрированная решетка (К12) с
координационным числом 12 и базисом,
равным 4 атомам (1/8)8
= 1 атом от числа атомов, расположенных
в вершинах куба (1/2)6
= 3 атомам от числа атомов, находящихся
в центре граней куба. Наименьшее
расстояние между атомами, выраженное
через период решетки «а», равно
![]() .
Коэффициент компактности 0,74 или
74 %. Решётку К12 имеют металлы: Fe;
Cu; Ni; Al; Co; Pt;
Ag; Au и др.
.
Коэффициент компактности 0,74 или
74 %. Решётку К12 имеют металлы: Fe;
Cu; Ni; Al; Co; Pt;
Ag; Au и др.
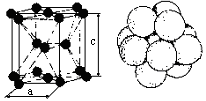
Гексагональная плотноупакованная решётка (Г12), которую определяют два периода «с» и «а». Период «а» колеблется от 2,28 до 3,38 , период «с» от 3,57 до 6,52 . Решётка Г12 характеризуется отношением периодов решетки с/а. Если это отношение равно или близко к 1,633, то получим гексагональную плотноупакованную решётку с координационным числом 12 и базисом, равным 6 атомам (1/6)12 = 2 атомам от числа атомов, расположенных в вершинах шестигранника, (1/2)2 = 1 атом от числа атомов, находящихся в центре шестигранника, плюс 3 атома, имеющихся внутри кристаллической ячейки. Коэффициент компактности 0,74 или 74 %. Решётку Г12 имеют металлы: Ti; Co; Be; Mg; Rn; Re; Os.
Если отношение с/а будет сильно отличаться от величины 1,633, то получим гексагональную не плотноупакованную решетку с координационным числом 6 и коэффициентом компактности 0,5 или 50 %. Обозначается она индексом Г6. Такую решетку имеет цинк, кадмий, ртуть, графит.
Правильное расположение атомов в монокристаллах обуславливает неодинаковую плотность заполнения атомами различных кристаллографических плоскостей и направлений. Многие свойства зависят от выбранного направления вырезки образца по отношению к направлениям в решетке, то есть то того, насколько плотно располагаются атомы в направлении, вдоль которого ведется измерение. Подобная неоднородность свойств монокристалла в разных кристаллографических направлениях называется анизотропией.
Аморфные тела (стекло, пластмассы и др.), свойства которых не зависят от направлений, называют изотропными.
Реальные металлы и сплавы состоят не из одного монокристалла, а из большего числа кристаллов, различно ориентированных в пространстве. Такое тело называется поликристаллическим. Кристаллы поликристаллического тела, имеющие неправильную форму, носят название зерен или кристаллитов. Несмотря на внутренние дефекты отдельных зерен, каждое из них обладает свойством анизотропии. Свойства реальных поликристаллических тел, вследствие произвольного расположения каждого из зерен, будут в различных направлениях примерно одинаковыми. Это явление называется квазиизотропией (ложной изотропией).