
- •1. Характеристика сульфата калия
- •2. Способы получения сульфата калия
- •3. Получение сульфата калия конверсией хлорида калия серной кислотой
- •3.1. Характеристика основного и вспомогательного сырья
- •3.2. Физико-химические основы взаимодействия хлорида калия с серной кислотой
- •3.3. Двухстадийная технологическая схема получения сульфата калия.
- •3.4. Характеристика используемых химических реакторов
- •3.5. Характеристика отходов, проблемы их обезвреживания и полезного использования.
3.2. Физико-химические основы взаимодействия хлорида калия с серной кислотой
Реакцию между хлоридом калия и серной кислотой в общем виде можно выразить уравнением (3.2.1).
2КС1 + H2SO4 = K2SO4 + 2HCl (3.2.1)
Она проходит в две стадии, которые можно выразить уравнениями реакций (3.2.2) и (3.2.3).
КС1 + H2SO4 = HC1 + KHSO4 (3.2.2)
KC1 + KHSO4 = НС1 + K2SO4 (3.2.3)
На самом деле процесс является более сложным вследствие протекания промежуточных реакций.
При 80, 170, 210 и 265 оС на дериватограмме исходной смеси 2КС1 + H2SO4 имеют место эндотермические эффекты (рис.1). Процесс заканчивается лишь при температуре 455 °С.
Смесь 4КС1 + H2SO4 (рис.2) при нагревании плавится по достижении 100 °С. При дальнейшем нагревании на дериватограмме имеют место три эндотермических эффекта – при 190, 230 и 300 оС. Процесс заканчивается при температуре 330 оС.
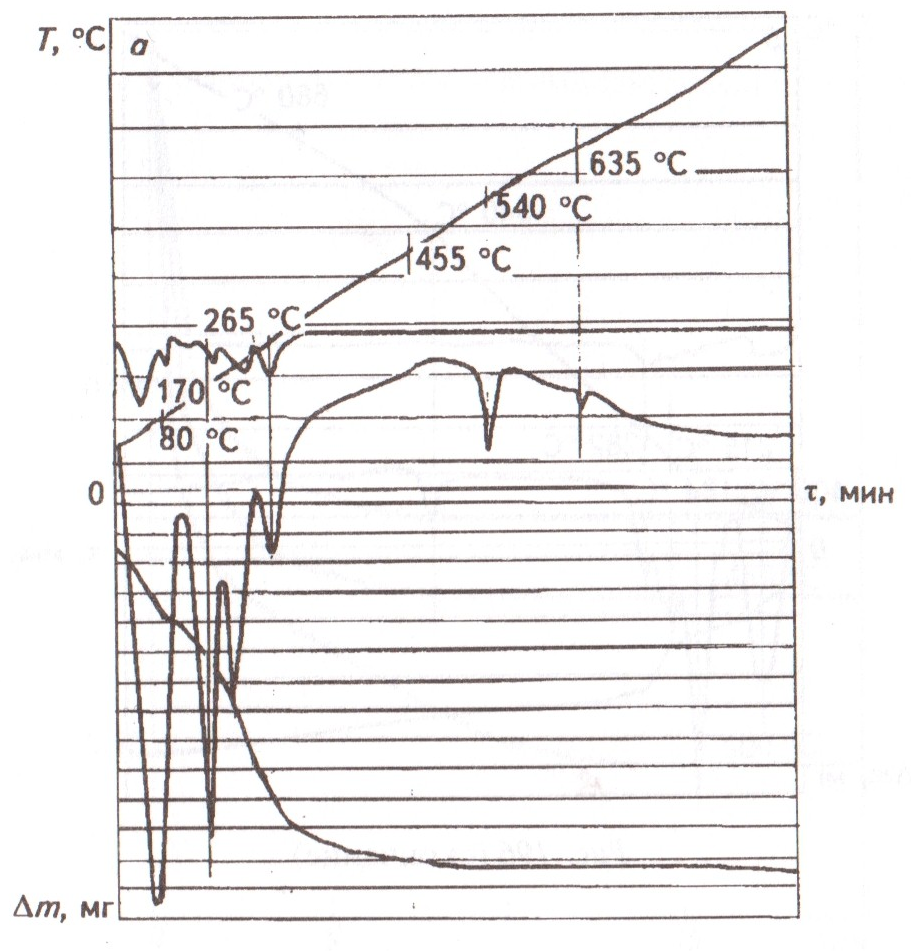
Рис. 1. Дериватограмма смеси H2SO4 + 2KCl
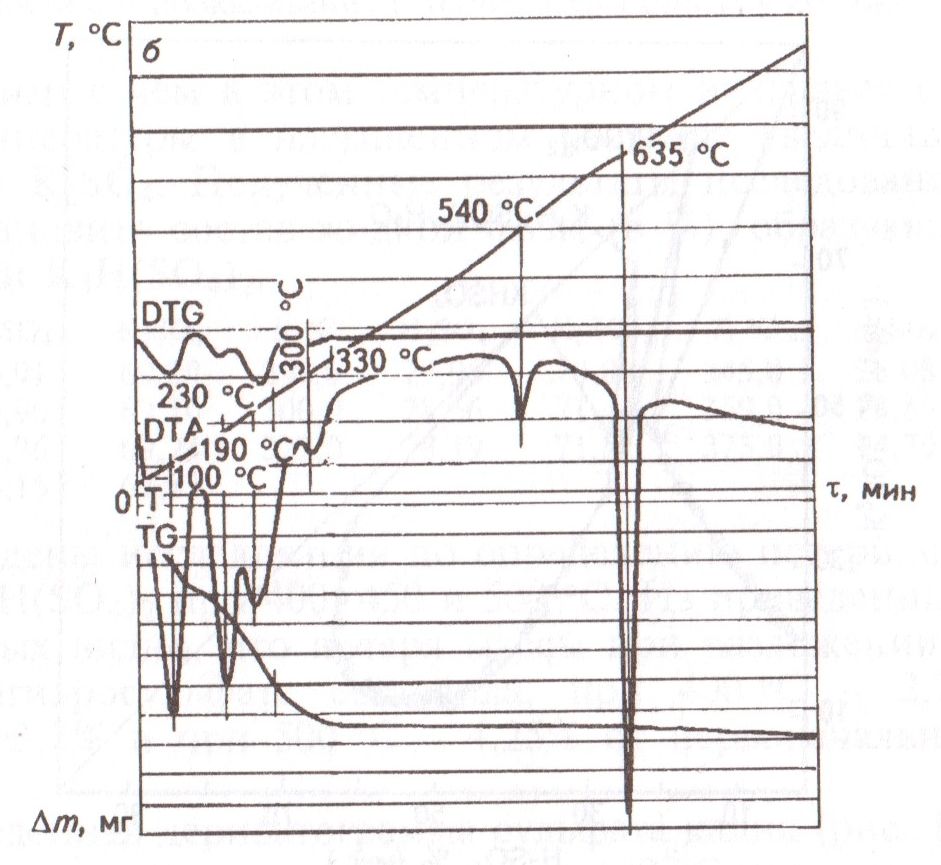
Рис. 2. Дериватограмма смеси H2SO4 + 4KCl
Приведенная на рис.3 дериватограмма смеси КСl + KHSO4 поясняет сказанное. Смесь плавится при 100, 184, 215 и 282 оС. Эти четыре эндотермических эффекта свидетельствуют о сложности протекающих в системе процессов, включающих и побочные, в которых происходит образование и видоизменение различных гидросульфатов калия. Процесс заканчивается лишь при 680 оС.
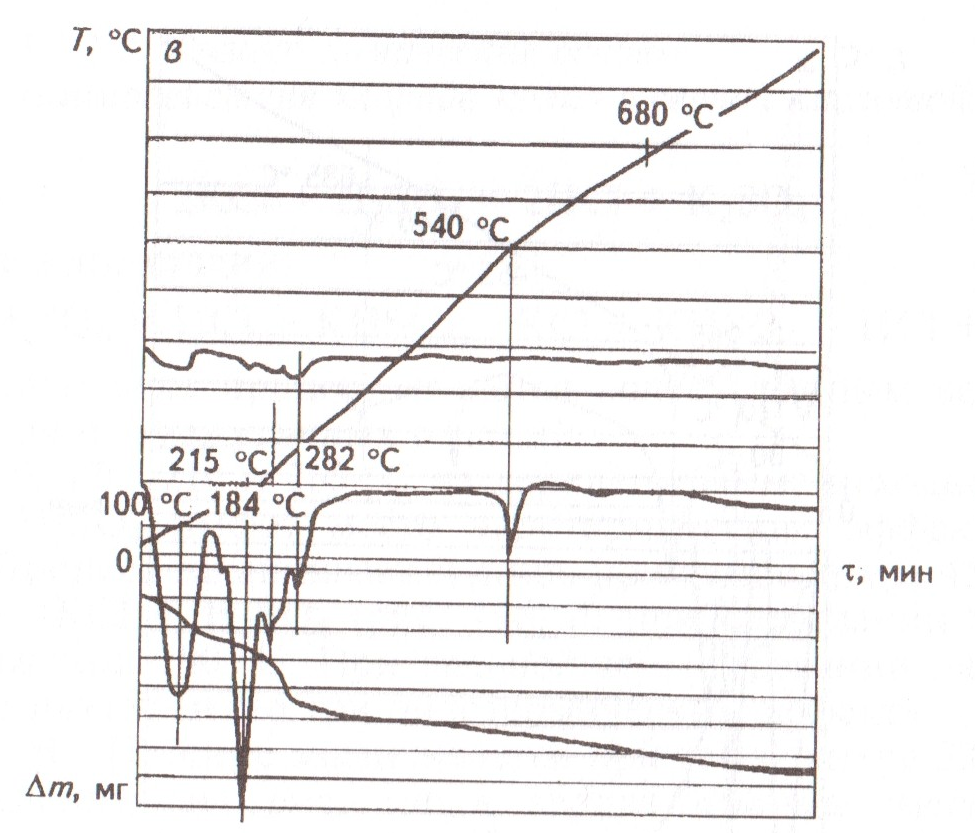
Рис. 3. Дериватограмма смеси KHSO4 + KCl
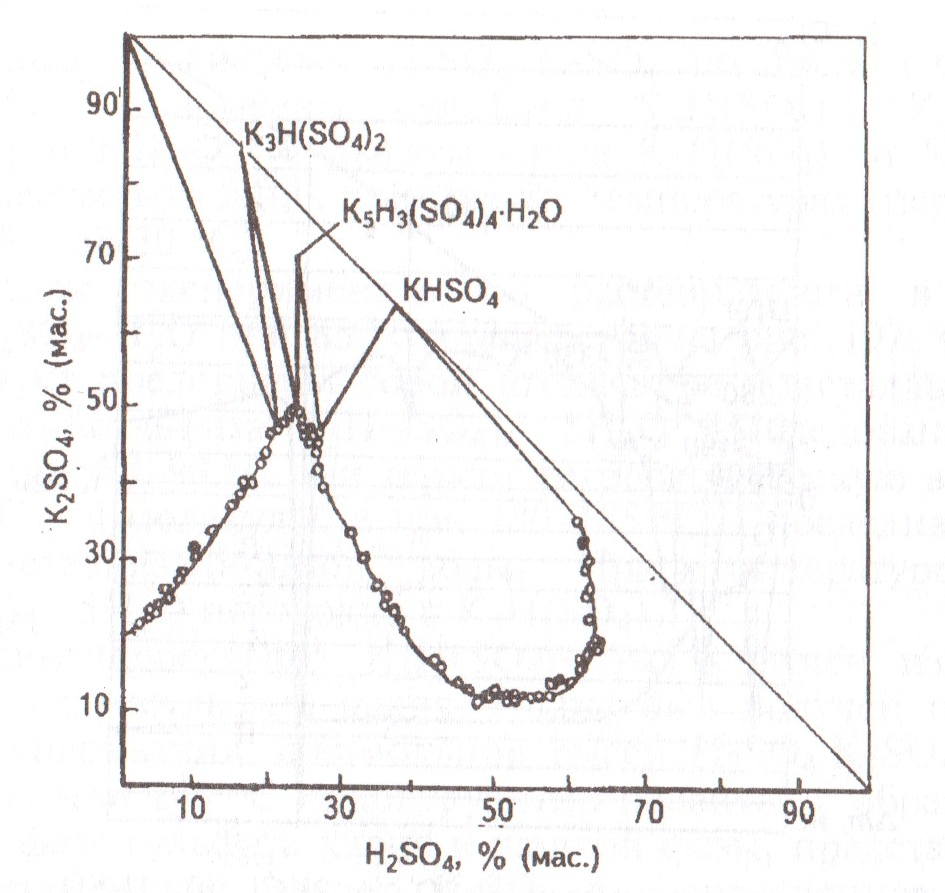 Рис.
4. Растворимость в системе
Рис.
4. Растворимость в системе
K2SO4 – H2SO4 – H2O при 85 оС
Исследования системы H2SO4 – K2SO4 показали следующее. При 18 оС обнаружены сульфаты K3H(SO4)2, K5H(SO4)2, K8H(SO4)2 и KHSO4. Сульфаты калия K8H(SO4)2 и K5H(SO4)2 могут существовать лишь при низких температурах (первый – до 75, второй – до 30 оС).
Результаты экспериментов по растворимости в системе K2SO4-H2SO4-H2O при 85 оС приведены на рис. 4. Осажденный продукт представлял собой игольчатые кристаллы тригидропентакалийсульфата K5H3(SO4)4 · 5H2O. Исследования показали, что при температуре от 80 до 90 оС они теряют гигроскопическую влагу: при температуре от 120 до 130 оС – 4 молекулы, а при температуре от 180 до 185 оС – последнюю молекулу кристаллизационной воды. При температуре 230 оС K5H3(SO4)4 · 5H2O переходит в K3H(SO4)2.
Трикалийгидросульфат K3H(SO4)2 был получен из горячих растворов гидросульфата калия. Позже был получен продукт в процессе упаривания эквимольной смеси H2SO4 : K2SO4.Трикалийсульфат при 268 оС инконгруэнтно плавится с образованием в твердой фазе сульфата калия и жидкой фазы, представляющей собой насыщенный раствор K2SO4 в расплавленном KHSO4. Диаграмма растворимости бинарной системы K2SO4 – H2SO4 изучена с 270 до 373 оС. В твердой фазе находится лишь сульфат калия, в связи с чем в этом температурном интервале с повышением температуры в насыщенном растворе увеличивается содержание K2SO4. Полученные результаты исследований позволили установить состав жидкой фазы (в %), образующийся при плавлении K3H(SO4)2, приведенный в табл.3.2.4.
Таблица 3.2.4
Состав жидкой фазы, образующийся при плавлении K3H(SO4)2.
T, оС |
H2SO4 |
K2SO4 |
T, оС |
H2SO4 |
K2SO4 |
T, оС |
H2SO4 |
K2SO4 |
264,3 |
30,91 |
69,09 |
298,0 |
29,96 |
70,04 |
345,0 |
26,08 |
73,92 |
271,0 |
30,90 |
69,10 |
300,0 |
28,56 |
71,44 |
359,0 |
25,89 |
74,11 |
288,0 |
30,76 |
69,24 |
322,0 |
28,19 |
71,81 |
373,0 |
24,70 |
75,30 |
296,0 |
30,15 |
69,85 |
– |
– |
– |
– |
– |
– |
Проведены исследования по определению потери массы расплава K3H(SO4)2 при 400, 450 и 500 оС. Из приведенных на рис. 5 данных видно, что потеря массы при разложении расплава трикалийгидросульфата составила: при 400 оС – 2,75 %, при 450 оС – 3,2 % и при 500 оС – 4,25 % от первоначальной массы образца.
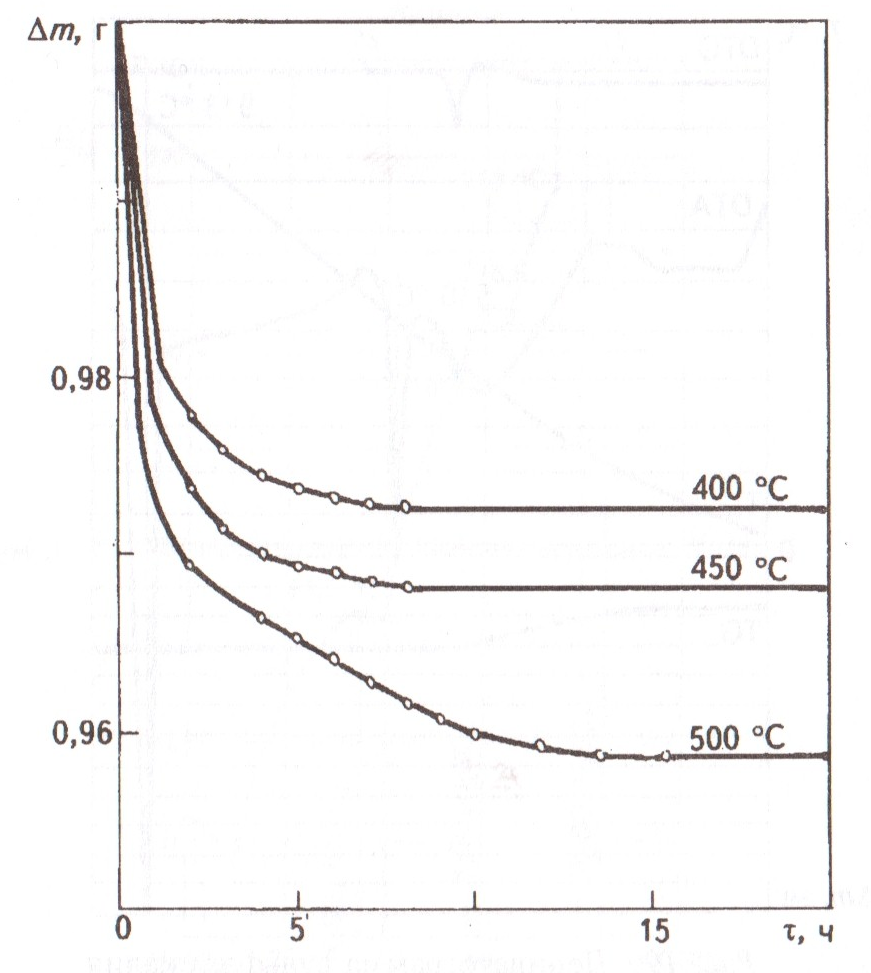 Рис.
5. Потери массы образца K3H(SO4)2
в зависимости от продолжительности
его прокаливания и температуры
Рис.
5. Потери массы образца K3H(SO4)2
в зависимости от продолжительности
его прокаливания и температуры

Рис. 6. Дериватограмма сульфата калия
Приведенная дериватограмма сульфата калия (рис. 6) показывает, что он при нагревании около 100 оС начинает разлагаться (теряет массу). Процесс продолжается до 460 оС. Далее на дериватограмме четка выявлены два эндотермических пика – при 510 и 913 оС.
На рис. 7 приведена диаграмма растворимости в системе H2SO4 – K2SO4, из которой видно, что с повышением температуры растворимость сульфата калия в серной кислоте возрастает. Процесс растворения сульфата калия в серной кислоте сопровождается образованием кристаллогидратов, которые при понижении температуры переходят в кристаллическое состояние. Это свидетельствует об особом значении температурного режима в технологии получения сульфата калия из хлорида калия.
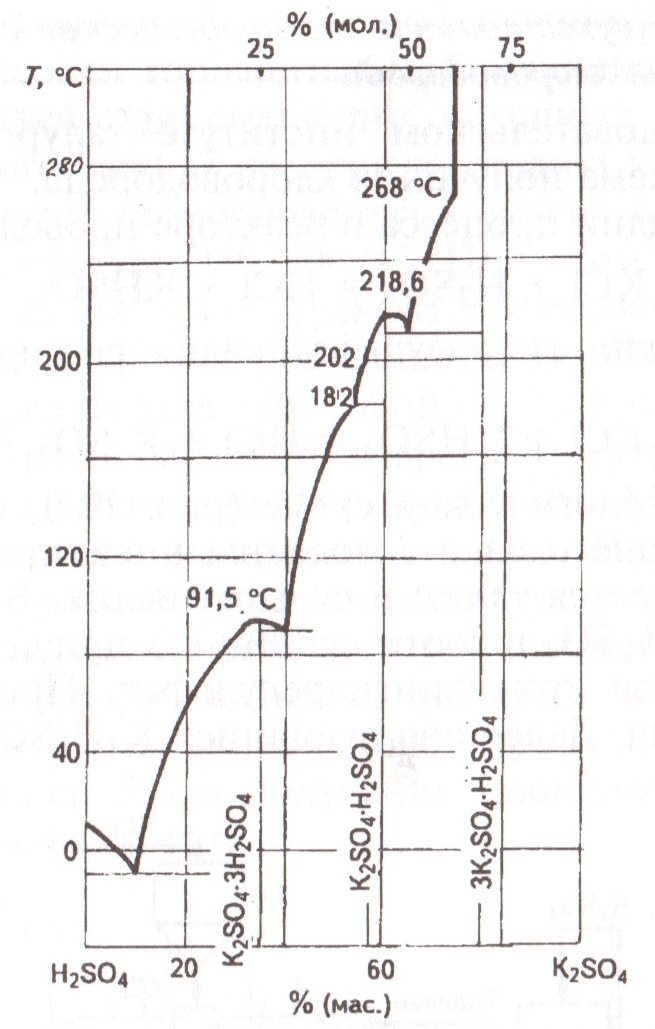
Рис. 7. Диаграмма растворимости в системе H2SO4 – K2SO4
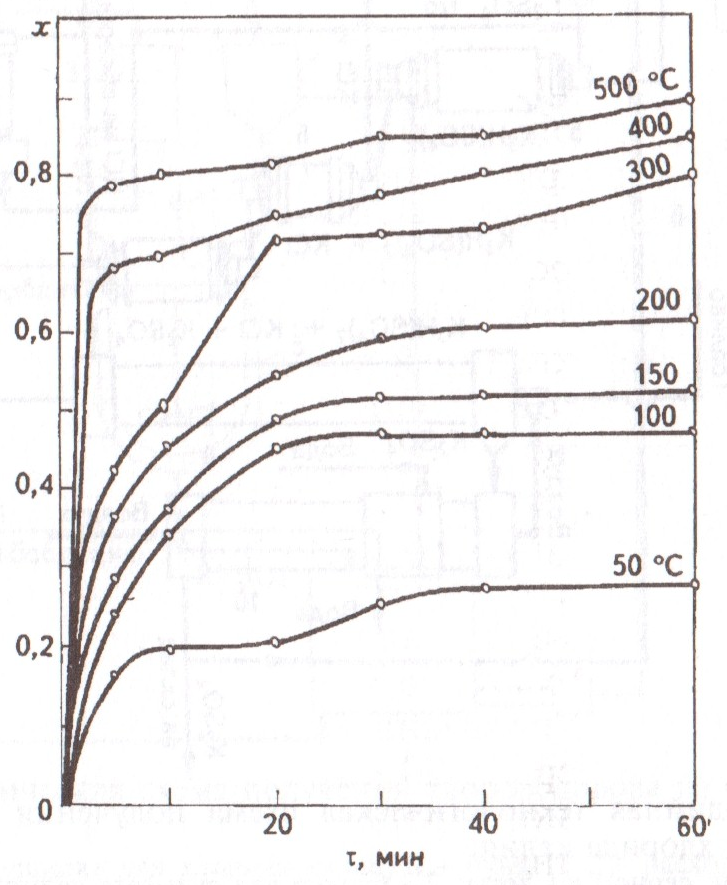
Рис. 8. Зависимость степени превращения х хлорида калия в сульфат калия от продолжительности реакции τ при различных температурах.
При анализе рентгенограмм продуктов взаимодействия хлорида калия с серной кислотой в течении одного часа при различных температурах получены следующие данные: от 20 до 200 оС отчетливо выражены пики KCl и KHSO4 и незначительно – K2SO4 и K3H(SO4)2; от 300 до 400 оС четко прослеживаются пики K2SO4, KCl и K3H(SO4)2; при более высоких температурах наиболее четко просматриваются пики сульфата калия, слабее – хлорида калия, а пики гидросульфата калия отсутствуют.
Кинетика реакции хлорида калия с серной кислотой при различных температурах показана на рис. 8. С наибольшей скоростью протекает в первые 20 минут. При более высоких температурах начальный период процесса протекает даже в течение 5 минут. Анализ полученных кинетических зависимостей показывает, что процесс происходит во внешнедиффузионной области; определяющим параметром процесса является температура.
