
- •Оглавление
- •Список основных сокращений
- •Введение
- •Глава 1. Структура и функции системы иммунитета
- •Виды иммунитета
- •Цитокины и интерлейкины
- •Поверхностные лейкоцитарные антигены и рецепторы
- •Гуморальные факторы врожденного иммунитета
- •Клетки естественного врожденного иммунитета
- •Лимфоидная система
- •Иммуноглобулины и антитела
- •Р ис. 1.3. Этапы развития клеток, принимающих участие в иммунном ответе
- •Глава 2. Антигены. Динамика иммунного ответа Антигены
- •Динамика иммунного ответа
- •Глава 3. Иммунитет и инфекции
- •Противобактериальный иммунитет
- •Противовирусный иммунитет
- •Противопаразитарный и противогрибковый иммунитет
- •Глава 4. Виды иммунопатологии
- •Иммунодефицитные болезни
- •Аллергия и аутоиммунные заболевания
- •I тип реакций. Анафилактические реакции (реагиновые, IgE- зависимые).
- •Анафилактический шок, приступ бронхиальной астмы, ринит, отек Квинке, крапивница Эозинофилы
- •II тип. Цитотоксические реакции.
- •III тип. Иммунокомплексные реакции.
- •Трансплантационный иммунитет
- •Противоопухолевый иммунитет
- •Глава 5. Иммунодиагностика. Оценка иммунного статуса
- •Специфические показатели иммунного статуса
- •Оценка реакции
- •Глава 6. Иммунотерапия и иммунопрофилактика
- •Противоинфекционные вакцины
- •Серотерапия. Иммунные антисыворотки и иммуноглобулины
- •IV. Природные, синтетические, генно-инженерные препараты:
- •Литература
- •Основы ИммуноЛогии Учебное пособие
- •210602, Витебск, пр. Фрунзе, 27
Р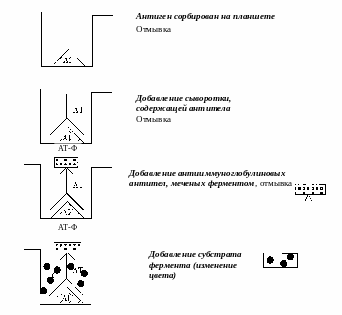
Оценка реакции
ис. 5.5. Принцип выявления антител
в твердофазном ИФА
Для выявления антител известный антиген адсорбируют в лунках полистироловой пластины. Затем вносят исследуемую сыворотку, в которой хотят обнаружить антитела к данному антигену. После инкубации лунки промывают для удаления несвязавшихся белков и вносят в них антииммуноглобулиновые антитела, меченные ферментом (обычно пероксидазой). После инкубации и отмывания в лунки добавляют специфичный для фермента субстрат (перекись водорода) и хромоген (орто-фенилендиамин) для регистрации конечных продуктов расщепления субстрата. О наличии и количестве антител судят по изменению цвета и интенсивности окраски раствора. Для регистрация окраски используют специальные спектрофотометры с вертикальным ходом луча (ридеры-мультисканы).
Методы ИФА обладают высокой чувствительностью и специфичностью и получили широкое распространение в различных областях биологии и медицины.
Иммуноблотинг (вестерн-блотинг).
Часто бывает, что АГ представляет собой сложную смесь разнородных молекул. С другой стороны, к такому комплексному АГ вырабатывается набор различных АТ. Для одновременного обнаружения различных фракций АГ либо АТ в исследуемом материале применяют метод вестерн-блотинга. В частности, он используется при диагностике ВИЧ-инфекции для обнаружения АТ к различным вирусным АГ. Для этого известный набор вирусных белковых АГ подвергают электрофорезу в полиакриламидном геле. АГ мигрируют в геле в зависимости от их молекулярной массы и заряда. После окончания электрофореза на пластину с гелем накладывают лист нитроцеллюлозной мембраны (НЦМ) и проводят повторный электрофорез в поперечном направлении. АГ выходят из геля и прикрепляются к листу нитроцеллюлозной мембраны.
Далее лист НЦМ с отпечатками АГ (блот – отпечаток) обрабатывают сывороткой больного, содержащей АТ. Если АТ есть, то они связываются с НЦМ по месту локализации различных фракций АГ.
Далее метод не отличается от гетерогенного иммуноферментного анализа: НЦМ промывают для удаления несвязавшихся белков и вносят в них антииммуноглобулиновые антитела, меченные ферментом (пероксидазой). После инкубации и отмывания НЦМ помещают в раствор субстрата (перекись водорода) и хромогена (диаминобензидин и др.) О количестве фракций антител к различным АГ фрагментам судят по появлению нескольких окрашенных пятен на НЦМ.
Радиоиммунологический анализ.
Принцип радиоиммунологического анализа (РИА) основан на выявлении комплекса АГ-АТ, в котором один из иммунореагентов был мечен радиоактивным изотопом. Обычно используют изотопы йода (125I или 131I). Учет реакции проводят по убыванию или по возрастанию радиоактивности (в зависимости от методики РИА) с помощью специальных счетчиков - или -излучения. Метод высокочувствителен, но постепенно вытесняется иммуноферментным анализом, учитывая небезопасность работы с радиоактивными изотопами и необходимость в сложном регистрирующем оборудовании.
Однако там, где в качестве АГ выступает низкомолекулярный гаптен (например, лекарственные препараты, стероидные и пептидные гормоны и др.) РИА используется весьма широко. Существуют его гетерогенные варианты, аналогичные ИФА, а также конкурентные варианты.
В последнем случае на твердую фазу (например, полистироловые шарики) сорбируют известные АТ в комплексе с радиоактивно меченым АГ (например, лекарственным препаратом) в известной концентрации. К этому комплексу добавляют исследуемый материал, содержащий неизвестную концентрацию изучаемого лекарственного препарата-АГ. Он вытесняет из комплекса меченый АГ пропорционально своей концентрации. Радиоактивность вытесненного АГ измеряют с помощью счетчика и определяют концентрацию неизвестного АГ.
Клеточные методы оценки иммунитета
Реакция бласттрансформации лимфоцитов (РБТЛ).
Переход малых лимфоцитов в бластные формы, способные к пролиферации и дальнейшей дифференцировке называется бласттрансформацией и сопровождается морфологическими изменениями лимфоцитов. Бласты – крупные, округлой формы клетки имеют большое ядро, занимающее большую часть цитоплазмы. В ядре содержится несколько крупных базофильных ядрышек, цитоплазма бластов зернистая. Одна бластная клетка может дать клон из 16-32 и даже 64 клеток, обладающих более высокой иммунокомпетентностью, чем исходный лимфоцит. Бласттрансформация лимфоцитов может быть вызвана специфическими антигенами и неспецифическими стимуляторами (митогенами). К бактериальным митогенам относятся полисахариды грамотрицательных бактерий, туберкулин микобактерий и др.
Способностью вызывать бласттрансформацию лимфоцитов обладают отдельные продукты животного (иммуноглобулин, выделенный из гетерологичной иммунной сыворотки) и растительного (фитогемагглютинин – ФГА) происхождения.
При постановке РБТЛ кровь или выделенные из нее лейкоциты вносят в среду RPMI или Игла, затем добавляют антиген или митоген. Учет реакции после внесения митогенов проводят через 2-4 суток, а после стимуляции антигенами через 3-5 суток. Неспецифический митоген ФГА трансформирует в бласты 30-50%, а ЛПС – до 30% лимфоцитов крови человека. Под влиянием специфических антигенов в бласты трансформируются не более 5-10% малых лимфоцитов.
Результаты РБТЛ можно учитывать морфологически – прямым подсчетом бластов на окрашенных препаратах под микроскопом или радиометрическим методом, измеряя уровень включения в ДНК лимфоцитов тимидина, меченного тритием.
Реакция подавления миграции лейкоцитов (РПМЛ).
Сущность ее в том, что в присутствии антигенов лимфоциты выделяют цитокины (лимфокины), в частности, фактор, подавляющий миграцию нейтрофилов и макрофагов. К взвеси лейкоцитов добавляют антиген и заполняют ею капиллярные трубочки (контроль – без антигена или посторонний антиген). Эти капилляры помещают в камеры или лунки, заполненные питательной средой. После инкубации при 370С 18 часов измеряют зону миграции клеток из капилляров или подсчитывают их количество в лунке. Если есть иммунные клетки (т.е. организм сенсибилизирован к антигену), то миграция лейкоцитов подавляется.
Кожные пробы и другие провокационные тесты
Для определения гиперчувствительности (аллергии) к антигенам-аллергенам у людей проводят провокационные тесты. Суть их в том, что соответствующий аллерген вводят в организм перорально, ингаляционно, наносят на кожу при ее скарификации или вводят внутрикожно. Обычно, спустя 30 минут оценивают немедленные аллергические реакции (ПЧНТ), а через 24-48 час – замедленные (ПЧЗТ).
На пыльцевые, пищевые, лекарственные аллергены чаще наблюдаются немедленные кожные реакции в виде покраснения и припухлости. Замедленные реакции развиваются на бактериальные антигены. Пробу Манту ставят для выявления сенсибилизации к микобактериям туберкулеза (оценка вакцинации и инфицированности). Туберкулин РРD вводят внутрикожно и при положительной реакции через 24-48 час в месте инъекции возникает воспалительная реакция. Она указывает на наличие сенсибилизации к этому антигену. Сильная реакция, или, наоборот, ее отсутствие (анергия) может быть при туберкулезе.
Кожные пробы могут использоваться для выявления иммунодефицитов и оценки резистентности к конкретной инфекции. Большинство людей встречались в течение жизни с антигенами распространенных условно-патогенных бактерий и в норме имеют к ним сенсибилизацию. При постановке внутрикожных проб с аллергенами стафилококка, стрептококка, кишечной палочки, протея, микобактерий туберкулеза (туберкулин) и другими, реакция должна быть положительной хотя бы на один из них. Отсутствие реакции может указывать на иммунодефицит.
