
- •Молекулярно-кинетические условия образования р-ра
- •Рассмотрим 3 основные стадии взаимодействия в-ва с рас-лем:
- •Диссоциация соединений различных классов.
- •Количественные характеристики процесса электролитической диссоциации.
- •Случай гидролиза:
- •Ионные реакции в растворах
- •Коллигативное (общее) свойство растворов
- •Понижение насыщенного пара рас-ля на рас-ом
- •Потенциал электрода
- •Элемент Даниэля-Якоби
- •Задача:
- •Kat восстановление окислителя происходит:
- •Элемент дифференциальной аэрации
- •Защита металлов от коррозии
- •Задача:
Количественные характеристики процесса электролитической диссоциации.
1.Степень диссоциации. Показывает какова доля молекул распавшихся на ионы относительно первоначального кол-ва молекул.
Степень диссоциации α 0÷1 ее истинное значение (0÷100%)
По способности к диссоциации электролиты условно разделяют на сильные и слабые.
1)Электролиты, которые в р-ре существуют преимущественно в виде ионов, наз-ют сильными. Для них принято α>30%
2)Электролиты, которые в растворенном состоянии нах-ся частично в виде молекул и частично в виде ионов, наз-ют слабыми.
Сильные электролиты:
а)Кислоты: самая сильная – хлорная – HСlO4, HCl, HBr, HI, HNO3, HCNS (радоновая кислота), HMnO4, H2SO4, H2SeO4, H2S2O3 (тиосерная кислота или серноватистая), HIO4
б)Основания:
Все гидроксиды щелочных металлов: LiOH, NaOH, KOH, RbOH, CsOH, щелочноземельных металлов: Ca(OH)2, Ba(OH)2, Sr(OH)2, TlOH.
в)Все растворимые соли
Слабые электролиты:
а) Кислоты: HF, H2SO3, H3PO4, HNO2, H2CO3(угольная), H2S(сероводородная), H2N, H2SiO3(кремниевая), H3BO3, HCOOH(муравьиная), CH2COOH(уксусная) и все остальные органические кислоты.
б)Основания: NH4OH и все плохо растворимые гидроксиды.
Степень диссоциации зависит от:
1.Природы в-ва и рас-ля
2.Температуры (с увеличением температуры α увеличивается, усиливается тепловое движение молекул колебательное движение атомов.
3.Концентраций растворов. С увеличением концентрации α увеличивается, уменьшается частота встреч друг с другом, приводящая к образованию молекул.
Константа диссоциации
В р-рах слабых электролитов устанавливается равновесие диссоциации, в р-ре находятся молекулы и ионы. Характеристикой установления равновесия является константа равновесия, в данном случае наз-ся константой диссоциации.
НАDН++А-

Кд постоянная для данного в-ва и зависит только от температуры.
Кд не зависит от концентрации, придает ей большую ценность чем степень диссоциации, при диссоциации слабых многоосновных кислот и многокислотных оснований, каждая ступень диссоциации характерезуется константой диссоциации, причем каждая последующая константа много меньше предыдущей.
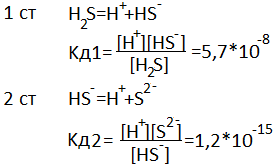
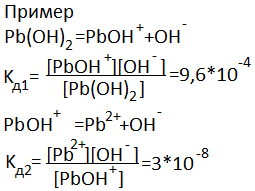
Смещение равновесия диссоциации
Обратимым процессом можно управлять, т.е. усиливать или ослаблядь диссоциацию

Связь степени диссоциации и константы диссоциации слабого электролита
HCN=H++CN-
[H+]=α*CHCN
[CN-]=α*CHCN
[HCN]=CHCN- α*CHCN = (1-α) * CHCN
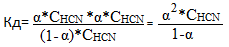
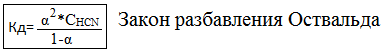
α<3%
в частности для 0,1 М р-ра синельной кислоты (HCN) α=0,007%
1-α1
Кд=α2С
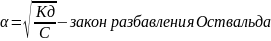
Расчет концентраций ионов солей в р-ре
Растворенные соли являются сильными электролитами, поэтому количественной характеристикой их диссоциации является только степень диссоциации.
Al2(SO4)3=2Al3++3SO42-
Cсоли, α-известно
С(Al3+)=2Ссолиα
С(SO42-)=3Ссолиα
С=NαC
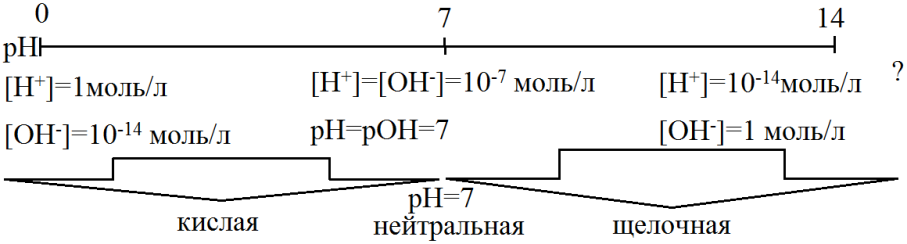
Шкала РН
Вода
яв-ся слабодиссоциирующим соединением.
Она дис-ет на катионы Н и анионы ОН.
Характеризуется уравнением равновесия:
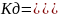
СН2О[H2O] (СН2О – аналитическая концентрация воды)
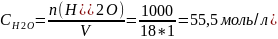
СН2Оconts
[H+][OH-]=Кд*CH2O=1,8*10-16*5,55=10-14 = Kw=Kв («ка бэ»)
[H+][OH-]=Kw=10-14 – ионное произведение воды
Это произведение всегда постоянно, во всех водных р-ов кислот, щелочей и солей при данной температуре.
Кислотно-основные св-ва р-ов.
Характеризуется концентрацией катиона H+ или концентрацией гидроксида иона ОН-. Эти величины в р-ре могут быть переменными, однако, их произведение всегда постоянно.
1.В
нейтральной среде концентрация
[H+]=[OH-]=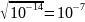 моль/л
моль/л
2.В
кислой среде [H+]>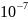 моль/л , [OH-]<
моль/л
моль/л , [OH-]<
моль/л
3.В щелочной среде [ОH-]> моль/л , [H+]< моль/л
р - отрицательный логарифм
р – «пауэ»
р – показатель степени
pH=-lg[H+]
pOH=-lg[OH-]
pNa=-lg[Na+]
pH+pOH=14
1. ,
pH=-lg[H+]
,
pH=-lg[H+]
2. pOH=-lg[OH-], pH=14-pOH
1.В нейтральной среде pH=pOH=7
2.В кислой среде 0рН<7
3. В щелочной среде 7<рН14
Расчет реакций среды в растворах кислот и оснований
1.Сильные кислоты.
Количественной характеристикой диссоциации сильных электролитов яв-ся степень диссоциации α
СН+=α*NH+*Cк-ты
рН=-lgCH+
Пример:
Сэк(H2SO4)=0,05н, α=80%, рН-?
H2SO4=2H++SO42-
CH+=0,8*2*0,05/2=0,04 моль/л
Z=2
pH=-lgCH+=-lg0,04=1,4
Если для сильных электролитов в задаче не дают степень диссоциации, то принимать α=1
2.Сильное основание
СОН-=α*NОН-*Cоснования
рОН=-lgCОН- , рН=14-pOH
CH+=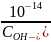 ,
рН=-lgCH+
,
рН=-lgCH+
Пример:
Вычислить рН 1% р-ра гидроксида бария, ρ=1,01 г/см3
m(Ba(OH)2)=Vр-ра*ρ*ω=1000*1,01*0,01=10,1г
пусть Vр-ра=1л
C(Ba(OH)2)=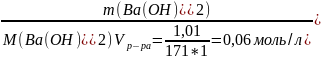
Ba(OH)2=Ba2++2OH-
COH-=α*NOH*Cосн=1*2*0,06=0,12 моль/л
рОН=-lg0,12=0,92
pH=14-pOH=14-0,92=13,08
3.Слабые кислоты
Количественными характеристиками диссоциации могут быть:
а)степень диссоциации
[H+]=α*Cк-ты
При расчете концентраций катионов H+ для слабых кислот принимается во внимание только 1 ступень диссоциации, т.е. для слабых многоосновных кислот всегда NH+=1
б)константа диссоциации
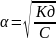
4.Слабые основания
а)[OH-]=α*Cосн
NОН-=1
б)
pH=14-pOH
Задача:
Расчитайте рН в децинормальном р-ре H2CO3 (0,14), а так же Кд1(H2CO3), в р-ре α(H2CO3)=0,17%
Сэк(H2CO3)=0,1 н
α=0,17%
Угольная кислота слабая
H2CO3 =H++HCO3-
[H+]=α*Cк-ты=0,0017*0,1/2=8,5*10-5моль/л
pH=-lg[H+]=4,07
Кд1+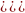
Карточка:
Даны р-ры электролитов. 1.напишите ур-ия диссоциации этих электролитов 2.по приведенным в таблице данным все остальные неизвестные величины
Электролит |
Кд1 |
α,% |
С, моль/л |
[H+] моль/л |
[OH-] моль/л |
рН |
рОН |
H2Se |
|
2*10-3 |
8*10-1 |
|
|
|
|
CsOH |
----- |
|
4*10-3 |
|
|
11,45 |
|
1. H2Se= H++НSe-
НSe-= H++ Se2-
CsOH= Cs++OH-
2.
1.) [H+]=α*Cк-ты=2*10-3*10-2*0,8=1,6*10-5
[OH-]=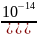
pH=-lg[H+]
pOH=-lg[OH-]
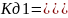
2.) [H+]=10-рН=10-11,45
[OH-]=10-14
pОH=14-pH=
[OH-]=α*Cосн
α=
Гидролиз солей
Опр. Гидролиз – процесс взаимодействия ионов соли с молекулами воды, приводящей к образованию мало диссоциирующих частиц (молекул или ионов), в результате которого меняется реакция среды, т.е. ионы взаимодействуют с водой.
Механизм гидролиза
Можно рассматривать как процесс поляризующего действия ионов на молекулы воды, в результате поляризации связи в молекуле воды возможен ее разрыв. KtAn=Kt++An-
1.Если катион взаимодействует с водой
![]()
2.Если анион взаимодействует с водой
![]()
Св-ва ионов поляризовать связи в молекулах наз-ся поляризующей способностью. Пол-ая способность ионов зависит от их размера и заряда и определяется величиной плотности заряда, т.е. отношения заряда к радиусу. Чем меньше заряд и больше радиус, тем больше пол-ая способность иона.
По значению пол-ей способности все ионы условно можно разделить на две группы:
1.Слабополяризующие ионы. Они не вызывают заметного разложения молекул воды, т.е. практически не взаимодействует с ней. Это ионы с большим радиусом и малым зарядом.
Это катионы, образующие сильные основания (Li+, K+, Na+, Rb+, Cs+, Ca2+, Sr2+, Ba2+) (Все сильные основания -это гидроксиды металлов 1 группы, все остальные образуют слабые основания.)(не растворимые основания – слабые, растворимые – сильные)
Это анионы, образующие сильные кислоты (Cl-, Br-, I-, NO3-, SO4 2-, ClO4 -, CNS -)( Сильные- хлорная, уксусная , HI иодоводородная, HBr бромоводородная, HCl хлороводородная, H2SO4 серная, HNO3 азотная, остальные -слабые.)
2.Среднеполяризующие ионы. Взаимодействуют с водой, вызывают ее разложение. Меняется реакция среды, т.е. происходит гидролиз.К этим ионам относятся: NH +, Mg 2+, Be 2+, Cu 2+, Fe 2+, Fe 3+, Al 3+
Это анионы, образующие слабые кислоты (S 2-, CH3COO -, CO3 2-, F -, SiO3 -, So3 2-, PO4 3-, NO2 -)
