
- •Квантовые числа для электрона в атоме:
- •Направление ионно-обменной реакции между двумя электролитами в растворе определяется возможностью образования их ионами осадка, газа или слабого электролита.
- •Степень гидролиза соли определяется следующими факторами.
- •К основным методам защиты от коррозии относятся:
- •Типы гетерогенных дисперсионных систем
Билет№1.Волновые свойства электрона. Уравнения Де-Бройля, Планка, Эйнштейна, Шредингера
В
основе квантово-механической теории
строения атомов лежит представление
о двойственности природы электронов
и других микрочастиц, то есть их
корпускулярно-волновые свойства. С
движущимся электроном ассоциируется
волна, длина которой определяется
уравнением
Де-Бройля:
 где λ
- длина волны, (м); m
- масса электрона; V-скорость
движения частицы (≈108
м/с), h
- постоянная Планка.
где λ
- длина волны, (м); m
- масса электрона; V-скорость
движения частицы (≈108
м/с), h
- постоянная Планка.
Билет №2. Состояние электрона в атоме. Квантовые числа.
Оно
определяет энергию электрона в атоме
водорода и одноэлектронных системах
(He+,
Li2+
и т. д.). Энергия электрона
где n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Главное
квантовое число
– n
- принимает только целые положительные
значения n
= 1, 2, 3…∞.
С увеличением n
энергия и размер электронного облака
(атомной орбитали) возрастает. Совокупность
атомных орбиталей с одинаковым значением
n
называют уровнем или электронным слоем.
Максимально возможное число орбиталей
и электронов на уровне, соответственно
равны - n2 и 2n2
и 2n2 .
.
Орбитальное квантовое число l определяет значения орбитального момента количества движения электрона и принимает значения от 0 до (n-1), например, при n = 3: l = 0, 1, 2. Характеризует форму атомных орбиталей (электронных облаков), для которых в зависимости от l приняты соответствующие обозначения:
l 0, 1, 2, 3, 4, 5…
обозначение s, p, d, f, g, h…
s - Орбиталь (s – электронное облако) имеет шарообразную форму. При l=1 зона вероятностного распределения электронов представляет собой гантелеобразное облако с центром в ядре (р-орбиталь). У d - орбитали (l = 2) и f - орбитали (l= 3) форма электронных облаков еще более сложная. Совокупность атомных орбиталей с одинаковым значением n и l называют подуровнем или электронной подоболочкой. Число возможных орбиталей и электронов в пределах подуровня, соответственно равны - (2l+1) и 2(2l+1).
Магнитное квантовое число - ml – может принимать положительные и отрицательные целочисленные значения от –l до +l через нуль. В зависимости от значений ml определяются возможные ориентации орбиталей одной формы и их число, которое равно количеству значений ml. Так, для s - орбиталей (l = 0, ml = 0), возможна одна ориентация, поскольку шар симметричен относительно трех осей ординат. Для р - орбиталей (l=1, ml = -1, 0, +1), что соответствует трем ориентациям р - орбиталей относительно трех осей. Для d - орбиталей (l=2, ml = -2, -1, 0, +1, +2) число возможных ориентаций – пять, для f – орбиталей - семь.
Спиновое (ms) квантовое число характеризует сложное движение электрона вокруг собственной оси; принимает значения +1/2 и –1/2
Билет №3. Основные сведения о строении атома. Электронное облако, электронные слои
В атоме водорода атомные орбитали (АО) на одном энергетическом уровне «вырождены» т.е. имеют одинаковые значения для всех подуровней. В многоэлектронных атомах из-за действия сил межэлектронного отталкивания уровни энергии расширяются в энергетическую зону с энергетическими подуровнями, обозначаемыми s-, p-, d-, f- подуровни. В пределах одного электронного слоя электронные состояния - s, p, d, f - отличаются по энергиям, причем Es < Ep < Ed <Ef. Поскольку состояния s, p, d, f в многоэлектронных атомах имеют разную энергию, их называют энергетическими подуровнями. Заполнение электронами квантовых слоев и энергетических подуровней в реальных атомах происходит с соблюдением трех основных принципов.
Билет№4. Принцип Паули правило Клечковского, Гунда
1.
Принцип наименьшей энергии.
Электроны занимают в атоме орбитали с
наименьшей энергией. Последовательность
расположения АО по уровням энергии при
заполнении электронами определяется
правилом
Клечковского:
электроны в невозбужденном атоме
располагаются в состояниях, где меньше
сумма (n+l),
так как энергия электронов зависит от
n
и l
и не зависит от  ml
и ms.
При одинаковом значении этой суммы в
первую очередь заполняется орбиталь с
меньшим значением главного квантового
числа (n).
Последовательность заполнения электронами
атомных орбиталей в порядке возрастания
энергии представлена в таблице:
ml
и ms.
При одинаковом значении этой суммы в
первую очередь заполняется орбиталь с
меньшим значением главного квантового
числа (n).
Последовательность заполнения электронами
атомных орбиталей в порядке возрастания
энергии представлена в таблице:
Вид атома |
Энергетические состояния |
Атом водорода |
1s<2s<2p<3s<3p<3d<4s<4p<4d<4d<5p<5s |
Многоэлектронные атомы |
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d<4f<6p<7s<6d<5f |
Принцип Паули. В атоме не может быть двух электронов, имеющих четыре одинаковых квантовых числа. Один электрон от другого на атомной орбитали должен отличаться спиновым квантовым числом. Как следует из принципа Паули, на атомной орбитали максимально может быть два электрона, отличающихся спином и это обозначается: ↑↓.
Правило Хунда. При заполнении энергетического подуровня, электроны стремятся заполнить свободные орбитали, сначала по одному с параллельными спинами, а затем по второму с противоположными спинами.
Распределение электронов по атомным орбиталям называют электронной конфигурацией атома. И представляют в виде а) полной электронной формулы, например: 22Ti 1s22s22p63s23p64s23d2; б) краткой электронной формулы: 22Ti [Ar]4s23d2; в) электроно-графической формулы, в которой атомные орбитали обозначают в виде клеток (энергетических или квантовых ячеек), а электроны – стрелками ↑↓.
Билет№5. Общая характеристика состояния электрона в многоэлектронном атоме. Квантовые числа
Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Следовательно, на одной орбитали может находиться не более двух электронов, отличающихся друг от друга значениями спинового квантового числа (спинами); максимальная емкость энергетического подуровня - 2(2l+1) электронов, а уровня - 2n2. Распределение электронов в атоме, находящихся в основном состоянии (его электронная конфигурация), определяется зарядом электрона. При этом электроны размещаются согласно принципа минимальной энергии: наиболее устойчивое состояние электрона в атоме соответствует минимально возможному значению его энергии. Конкретная реализация этого принципа может быть осуществлена на основе правила Клечковского: с ростом атомного номера элемента электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального чисел (n+l); при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением главного квантового числа n. Последовательность заполнения энергетических подуровней в основном соответствует следующему ряду: 1s 2s 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p и т.д. При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в пределах энергетического подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. В таблице 1.1 приведены значения квантовых чисел для различных состояний электрона, а также указано максимальное количество электронов, которое может находиться на том или ином энергетическом уровне и подуровне в атоме. Существует два способа составления схем распределения электронов в атоме: а) в виде формул электронных конфигураций, например, для 19К – 1s22s22p63s23p64s1, где показатель степени указывает число электронов на данном подуровне; б) в виде квантовых ячеек – для изображения электронной орбитали и стрелок, направление которых указывает на ориентацию спинов электронов:
Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы. Каждая атомная орбиталь характеризуется набором из трех квантовых чисел: главного n, орбитального l и магнитного ml.
Главное квантовое число n характеризует энергию атомной орбитали. Оно может принимать любые положительные целочисленные значения. Чем больше значение n, тем выше энергия и больше размер орбитали. Решение уравнения Шрёдингера для атома водорода дает следующее выражение для энергии электрона:
E = −2π2me4 / n2h2 = −1312,1 / n2 (кДж/моль)
Таким образом, каждому значению главного квантового числа отвечает определенное значение энергии электрона. Уровни энергии с определенными значениями n иногда обозначают буквами K, L, M, N... (для n = 1, 2, 3, 4...).
Орбитальное квантовое число l характеризует энергетический подуровень. Атомные орбитали с разными орбитальными квантовыми числами различаются энергией и формой. Для каждого n разрешены целочисленные значения l от 0 до (n−1). Значения l = 0, 1, 2, 3... соответствуют энергетическим подуровням s,p, d, f.
Форма s-орбиталей сферическая, p-орбитали напоминают гантели, d- и f-орбитали имеют более сложную форму.
Магнитное квантовое число ml отвечает за ориентацию атомных орбиталей в пространстве. Для каждого значения l магнитное квантовое число ml может принимать целочисленные значения от −l до +l (всего 2l + 1 значений). Например, р-орбитали (l = 1) могут быть ориентированы тремя способами (ml = -1, 0, +1).
Электрон, занимающий определенную орбиталь, характеризуется тремя квантовыми числами, описывающими эту орбиталь и четвертым квантовым числом (спиновым) ms, которое характеризует спин электрона - одно из свойств (наряду с массой и зарядом) этой элементарной частицы. Спин - собственный магнитный момент количества движения элементарной частицы. Хотя это слово по-английски означает "вращение", спин не связан с каким-либо перемещением частицы, а имеет квантовую природу. Спин электрона характеризуется спиновым квантовым числом ms, которое может быть равно +1/2 и −1/2.
Квантовые числа для электрона в атоме:
главное квантовое число |
n |
орбитальное квантовое число |
l |
магнитное квантовое число |
ml |
спиновое квантовое число |
ms |
Билет№ 6. Периодический закон. Периодическая система элементов.
Химические элементы по структуре невозбужденных атомов подразделяются на естественные совокупности, что отражено в периодической системе в виде горизонтальных и вертикальных рядов - периодов, групп.
Период представляет собой последовательный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных слоев. Номер периода совпадает со значением главного квантового числа n внешнего энергетического уровня. Элементы в соответствии с максимальным числом электронов на внешнем слое невозбужденных атомов подразделяются на вертикальные ряды-группы.
Положение в группах s- и р-элементов определяется общим числом электронов внешнего слоя. Например, сера (3s23р4), имеющая на внешнем слое шесть электронов, относится к шестой группе (главной подгруппе). Положение в группах d-элементов обусловливается общим числом s-электронов внешнего и d -электронов предвнешнего слоев. Например, титан (3d24s2) располагается в четвертой группе, побочной подгруппе.
Билет№7. Периодичность изменения химических свойств элементов и их соединений.
С развитием теории строения атома получает свое толкование и основа периодической системы элементов - периодический закон: периодическое изменение свойств элементов зависит от периодического повторения аналогичных электронных структур атомов. Кроме атомного веса, который остается основной константой элемента, выражая массу его атомов, на первое место выступает порядковый номер элемента (заряд ядра), определяющий его место в периодической системе и, тем самым, электронную структуру атома. Поэтому периодический закон получает свою новую формулировку.
Билет№8. Структура периодической системы. Электронные аналоги.
Последовательность заполнения электронных оболочек атомов периодической системы выглядит следующим образом:
- начало нового электронного слоя соответствует началу нового периода. Число элементов в данном периоде определяется максимальным количеством электронов на заполняемых подуровнях. Каждый период заканчивается элементом, имеющим заполненный внешний p - подуровень (инертные газы).
- элементы, атомы которых имеют подобную электронную конфигурацию, являются электронными аналогами и образуют группу периодической системы. К главной подгруппе относятся элементы, у которых на стадии заполнения находятся s- и p- атомные орбитали (s- и p-элементы). К побочной подгруппе относятся элементы, у которых заполняются d-орбитали (d-элементы). Химическая природа атома зависит от способности отдавать или принимать внешние и предвнешние электроны.
Билет№9. Свойства атомов элементов. Изменение свойств по группе и периоду.
Свойства элементов находятся в периодической зависимости от их атомных весов и от порядковых номеров, определяющих заряд ядра и электронную структуру атомов. Структура электронных оболочек имеет громадное значение для свойств элементов. Решающую роль проявления тех или иных химических свойств играет при этом внешняя оболочка. Все свойства элементов, определяемые электронной оболочкой атома, закономерно изменяются по периодам и группам периодической сиcтемы.
Билет№10. Потенциал ионизации, энергия сродства к электрону, электроотрицательность. Изменение в периодах и группах.
Химическая природа элемента может быть оценена способностью атома терять и приобретать электроны. Эта способность количественно может быть оценена энергией ионизации атома и его сродством к электрону.
Энергия ионизации - количество энергии, необходимое для отрыва электрона от невозбужденного атома с превращением последнего в положительно заряженный ион. Э° +J = Э+ + ē - выражается в кДж/моль или эВ/атом. I эВ = 94,48 КДж/моль или 1,602 10-19Дж.
Значения энергии ионизации в эВ/атом численно равны потенциалам ионизации в вольтах. При отрыве от атома первого, второго, n-го электронов различают первый, второй ... n-й потенциалы ионизации. Потенциал ионизации тем больше, чем больше заряд ядра и меньше радиус атома или иона.
Сродство к электрону-энергетический эффект E процесса присоединения электрона к нейтральному атому Э с превращением его в отрицательный ион.
Э° + ē = Э- + Е .
Сродство к электрону может быть выражено в Дж/моль или эВ/атом. Сродство к электрону возрастает с уменьшением радиуса. Наибольшим сродством к электрону обладают р-элементы VII группы.
Электроотрицательность
(ОЭО)
- способность атома данного элемента к
оттягиванию на себя электронной плотности
по сравнению с другими элементами
соединения. Количественно ОЭО выражается
полусуммой его энергии ионизации и
сродства к электрону. В периоде
величина ОЭО растет слева
направо,
а в подгруппах
уменьшается сверху
вниз
В периоде
величина ОЭО растет слева
направо,
а в подгруппах
уменьшается сверху
вниз
Билет№11. Виды химической связи.
В зависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи; ковалентную, ионную, металлическую.
Главную роль в межатомных взаимодействиях играют те электроны, которые связаны в атоме наименее прочно. Эти электроны обусловливают возникновение химических (валентных) связей между атомами при образовании молекул. Их называют валентными. Квантово-механические расчеты показывают, что взаимодействовать (вступать в связь) могут только те атомы, у которых имеются неспаренные электроны.
Если в нормальном состоянии (невозбужденном) на внешнем уровне атома нет спаренных электронов, то при затрате сравнительно небольшой энергии извне в пределах одного и того же уровня происходит процесс разъединения электронной пары. Например, возбуждение может произойти из s- состояния в р-состояние, из р- в d- состояние.
Способность каждого элемента к образованию химических связей называется валентностью. Валентность хлора в нормальном состоянии равна 1, при С1*- 3, при Cl** - 5, при Cl*** - 7. Химическая связь в основном осуществляется так называемыми валентными электронами. У s- и р-элементов валентными являются электроны внешнего слоя, а у d-элементов - электроны s -состояния внешнего слоя и d- состояния предвнешнего слоя.
Нормальное состояние Возбужденное состояние
4Ве
1s22s2 4Ве*
1s22s12p1

17CI ls22s22p63s23p5 C1* 3 2Зр43d1 число непарных
электронов – 3
Для атома хлора возможны следующие возбуждения
Нормальное
с
Первое возбужденное состояние, число непарных электронов -3 3s23p43d1
остояние:


Второе возбужденное состояние, число непарных электронов-5
3s23р33d2

Третье возбужденное состояние, число непарных электронов-7
3s13р33d3

Билет№12. Основные представления о ковалентной связи. Механизм образования сигма- и пи- связей.
Ковалентная связь сосредоточена между двумя атомами, она двухцентровая, двухэлектронная и осуществляется одной или несколькими общими электронными парами.
Ковалентная связь может образоваться по обменному и донорно-акцепторному механизмам.
Обменный
механизм:
электронные облака непарных электронов,
взаимно перекрывая друг друга, образуют
общие электронные облака (молекулярные)
с более высокой электронной плотностью,
например, Сl2,
N2,
H2O,
HCI.
Например, при образовании молекул Cl2,
N2
образуются общие электронные облака
(одно, три), симметрично располагающиеся
в пространстве относительно обоих ядер
атомов, связь неполярна.

В случае образования молекул HCl, H2O и других общие электронные облака несимметричны и смещены к более электроотрицательному элементу Cl, 0; связь полярна.
Р
:
азличают σ-, π- и δ-(дельта) перекрывание (связи). σ–связь осуществляется при перекрывании электронных облаков вдоль линии соединения ядер атомов. В образовании σ – связи могут участвовать все атомные орбитали:σs-s; σs-p; σs-d; σs-f; σp-p; σp-d; σp-f; σd-d;σf-f;

π-связь образуется за счет взаимного перекрывания электронных облаков перпендикулярно линии соединения центров ядер (σ).
К ним относятся связи πp-p; πd-d; πd-f; πf-f . S-орбитали не принимают участия в образовании π-связи, δ(дельта)-связи встречаются в соединениях между атомами переходных элементов, например в ионе (Re2Cl8)2-.
Донорно-акцепторный механизм (ДАМ). В этом случае различают атом-донор, представляющий при образовании связи двухэлектронное облако, и атом-акцептор: имеющий свободную орбиталь.
Рассмотрим образование иона NH4+ из молекулы аммиака и -катиона водорода, имеющего свободную орбиталь. Атом азота в молекуле аммиака имеет неподеленную 2s-электронную пару (донор), а катион водорода - свободную орбиталь (акцептор):

В
ионе аммония атом азота образует три
ковалентных N-Н-связи
путем перекрывания 3 одноэлектронных
р - облаков азота с 3 электронами 3 атомов
водорода, а четвертая N-Н
связь образуется по ДАМ. Ковалентную
связь, образованную по ДАМ,условно
обозначают стрелкой ( ).
).
Билет№13. Свойства ковалентной связи. Насыщаемость.
Насыщаемость: молекулы имеют определенный состав и существуют в виде дискретных частиц с определенной структурой за счет насыщаемости. Атом углерода в СН4 может принимать (перекрываться) только с четырьмя атомами водорода. Здесь насыщены четыре валентности углерода и валентности четырех атомов водорода. Бор благодаря этому свойству четырех насыщаем, атом бора в возбужденном состоянии имеет только три непарных электрона и одну свободную р – орбиталь:
5B
 – 1s22s22p1
5B*2s12p2
– 1s22s22p1
5B*2s12p2

При образовании иона ВН4- возбужденный атом бора образует 3 В-H -связи по обменному механизму, а четвертая связь образуется за счет свободной р-орбитали атома бора и неподеленной электронной пары гидрид иона (:Нˉ).
В этом ионе атом бора - акцептор, а гидрид ион :H-- донор.
Направленность связи определяется формой электронных облаков и различными способами их взаимных перекрываний. Для молекул типа АА, АВ, Н-Н, H-Cl направленность имеет линейный характер. У них возникает одна одинарная связь (σ-связь) -перекрывание облаков происходит в направлении прямой, соединяющей ядра атомов.
Молекулы А2В, в которых центральный атом В участвует двумя р-электронами в образовании ковалентных связей, располагающихся в пространстве под углом 90°, имеют угловую или пирамидальную направленность, как в молекулах H2O, NH3.
Между атомами может осуществляться кратная связь, двойная или тройная. В молекуле азота р-электроны внешнего слоя в каждом из атомов расположены по осям Рх, Ру, Рz, между атомами азота образуются одна σ -связь по линии, соединяющей ядра атомов, и две π-связи путем перекрывания Ру, Рz облаков обоих атомов, направленных перпендикулярно линии направления σ –связи
Билет№14. Свойства ковалентной связи. Поляризуемость.
Поляризуемость связи. Для характеристики реакционной способности молекул важно знать не только исходное распределение электронной плотности, но и ее поляризуемость. Поляризуемость характеризует способность связи становиться полярной или более полярной в результате действия на молекулы внешнего электрического поля. В результате поляризации может произойти полный разрыв связи с переходом связывающей электронной пары к одному из атомов с образованием отрицательного и положительного ионов. Это гетеролитический разрыв (ионизация).

При гомолитическом разрыве разрушается связывающая электронная пара и HCl распадается на атомы.
? Билет№15.Электроотрицательность атомов элементов. Полярность связей. Полярность молекул.
Связь, образованная различными атомами, отличающимися ЭО, называется полярной (гетерополярной). В таких молекулах электронная плотность перекрывающихся электронных облаков смещена к более ЭО атому. Полярность связи обуславливается различием ЭО и размеров атомов. Полярность связи обуславливает полярность молекулы – то есть несимметричное распределение электронной плотности, при котором «центры тяжести положительных и отрицательных зарядов» в молекуле не будут совпадать в одной точке. Между ними возникает какое-то расстояние – дипольное расстояние или длина диполя. Количественно полярность молекул оценивается величиной электрического дипольного момента. Электрическим дипольным моментом (μп) называется произведение абсолютного заряда электрона q на расстояние между зарядами (длина диполя l) и выражается в дебаях (1Д= 10-30 Кл·м): μп=q∙l. Электрический дипольный момент – величина векторная, то есть характеризуются направленностью (условно от положительного к отрицательному заряду).
Электрический дипольный момент молекулы определяется, как векторная сумма электрических дипольных моментов связей и, следовательно, зависит от полярности связей и геометрии молекулы. Неполярные молекулы это молекулы с неполярными связями, а также молекулы, имеющие симметрично (линейная, плоско-треугольная, тетраэдрическая, октаэдрическая ориентация) расположенные вокруг центрального атома одинаковые полярные связи. Полярными являются молекулы, содержащие полярные связи и несимметричное геометрическое строение.
Поляризуемостью ковалентной связи и (или) молекулы называют ее способность под действием внешнего электрического поля становиться полярной или более полярной. Поляризуемость π-связи выше, чем поляризуемость σ-связи. Поляризуемость молекулы возрастает с увеличением ее объема и числа π-связей. Постоянный момент диполя полярной связи (молекулы) μn в электрическом поле становится больше на величину μi, равную временному наведенному или индуцированному диполю μ=(μn+μi). Роль внешнего электрического поля могут играть заряженные частицы, входящие в состав самого соединения (ионы или атомы с большим эффективным зарядом). Поляризующее действие иона приводит к деформации электронной оболочки соседней частицы, которая тем больше, чем больше их поляризуемость.
Билет№16.Основное и возбужденное состояния атома. Валентность, степень окисления.
Билет№18.Гибридизация электронных орбиталей. Геометрия молекул. Валентный угол.
Гибридизация осуществляется в центральном возбужденном состоянии атома.
Очень часто атомы образуют связи за счет электронов разных энергетических состояний. Например, у возбужденного атома бериллия Be* (2s12р1) в образовании связи участвуют один s- и один р-электроны внешнего слоя; у возбужденного атома бора (2s12p2) –один s- и два р-электрона. В этом случае происходит так называемая гибридизация: первоначальная форма электронных облаков (орбиталей) взаимно изменяется и образуются облака (орбитали) новой, но уже одинаковой формы (q). На рисунке показан вид гибридного облака, возникающего при комбинации облаков s- и р-электронов. Гибридное облако имеет бóльшую вытянутость по одну сторону от ядра, чем по другую.

Электроны s- и р-подуровней переходят, таким образом, на некоторый средний энергетический более выгодный гибридный подуровень. Гибридизация связана с энергетическим выигрышем за счет образования более прочных связей, более симметричного распределения электронной плотности. Различают sp, sp2, sp3, sp3d1-2-гибридизацию: BeCl2, BCl3 СН4, SF6. sp – гибридизация в центральном атоме Be в молекуле BeCl2. 4Be 1s22s2;
Be*1s22s12p1;
Be*
2s 2p
p
SP
Две SP -
SP
SP2

(s+p)
)
Две sp
Комбинация одной s- и одной p– орбиталей приводит к образованию двух гибридных орбиталей расположенных под углом 1800; sp2–гибридизация в центральном возбужденном атоме бора.

sp2
3q
S+p+p
Три sp2 - гибридные орбитали
К
(S+P+P)
Три SP2-
омбинация одной s- и двух p– орбиталей приводит к образованию трех гибридных sp2- орбиталей (3q), расположенных под углом 1200 (плоский треугольник).Под таким же углом располагаются и связи, образованные в молекулах (BF3, BCl3, GaCl3);
sp3 – гибридизация проявляется в возбужденном атоме углерода в молекулах (СH4, СF4).
Комбинация одной s- и трех p– орбиталей приводит к образованию четырех гибридных орбиталей (4q), расположенных под углом 109028′.
109028’ |
(S+P+P+P)
Четыре SP3
sp3
109028’
Ковалентная связь в зависимости от симметричности расположения общих электронных пар внутри молекулы делится на два вида: полярную и неполярную.
Билет№19. Ионная связь и ее свойства.
Ионная связь это предельный случай полярной ковалентной связи, образуется при взаимодействии атомов элементов, сильно отличающихся по электроотрицательности (типичные металлы с активными неметаллами), например, NaCl, KBr. Атом металла за счет оттягивания электронной плотности к атому с большей ЭО превращается в положительно заряженный ион (+), а атом неметалла - в отрицательно заряженный ион (-). Разноименно заряженные ионы металла и неметалла притягиваются друг к другу зa счет электростатических сил по закону Кулона.
Ненаправленность и ненасыщаемость ионной связи
Электрические заряды ионов определяют стехиометрический состав соединений, так как разноименные заряды ионов обусловливают их притягивание и отталкивание.
Силовые поля ионов равномерно распределяются во всех направлениях в пространстве и поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, поэтому ионная связь характеризуется ненаправленностью*
 Рис.*1
Распределение электрических силовых
полей двух разноименных ионов
Рис.*1
Распределение электрических силовых
полей двух разноименных ионов
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Вследствие этого у ионов сохраняется способность притягивать ионы противоположного знака и по другим направлениям, следовательно, ионная связь характеризуется ненасыщаемостью (рис.1).
Билет№20. Металлическая связь. Деление элементов на металлы и неметаллы.
Металлическая связь - сильно нелокализованная химическая связь. Небольшое число электронов одновременно связывает большое число атомных ядер, а сами электроны перемещаются в кристаллической решетке металла.
Пример: атом лития, имеющий электронную конфигурацию 1s22s22р0, на внешнем уровне имеет четыре орбитали и один электрон; литий кристаллизуется в объемно-центрированной решетке. Каждый атом в кристаллической решетке имеет по восемь соседних атомов и в кристалле лития орбитали соседних атомов перекрываются. Каждый атом лития предоставляет на связь четыре валентные орбитали 2s _ и 2р _ _ _ и один валентный электрон. Всего в монокристалле с такой упаковкой будет 36 орбиталей (9·4=36) и 8 электронов.
 Рис.4.
Взаимная координация атомов в кристалле
лития
Рис.4.
Взаимная координация атомов в кристалле
лития
Известно, что атомы металла характеризуются малой энергией ионизации и валентные электроны слабо удерживаются в атоме и легко перемещаются из одной орбитали в другую. Таким образом, электроны принимают участие в образовании связи между атомами кристалла металла. Перемещение электронов по кристаллу определяют электрическую проводимость металла. Металлическая связь сильно делокализована.
Исходя из сказанного, металл можно рассматривать как плотноупакованную структуру из положительно заряженных ионов, связанных друг с другом коллективизированными электронами (электронным газом).
Билет№21. Межмолекулярные взаимодействия. Агрегатное состояние веществ. Комплементарность.
Связи сцепления, действующие между молекулами, известны как ван-дер-ваальсовы силы (по имени голландского ученого). Они проявляются между молекулами веществ в любом агрегатном состоянии: газообразном, жидком и твердом.
Ван-дер-ваальсовы силы действуют на очень малом расстоянии, примерно 10-7 см. Природа этих сил электрическая: заряды одной молекулы взаимодействуют с противоположными зарядами другой. Ван-дер-ваальсовы силы состоят из трех видов взаимодействия: ориентационного, индукционного и дисперсионного.
Билет№22. Водородная связь
Водородная связь. Атом водорода, вступая в соединение полярного типа, не утрачивает своей реакционной способности, обладая очень малыми размерами, создает электрическое поле высокой напряженности. Ничтожно малый по размеру положительно поляризованный атом водорода глубоко внедряется в электронную оболочку соседнего отрицательно поляризованного атома, образуя связь, называемую водородной. Водородная связь образуется за счет сил электростатического и донорно-акцепторного взаимодействий. Положительно поляризованный катион водорода выступает в роли акцептора. Так, молекула воды может образовать четыре водородных связи за счет двух атомов водорода и двух несвязывающих электронных пар атома кислорода. Водородная связь обозначается тремя точками. Водородная связь играет важную роль при ассоциации молекул, в процессе кристаллизации, растворения, образования кристаллогидратов.

Ассоциация молекул воды водородной связью (…)
Билет№23. Дисперсионные и ориентационные взаимодействия молекул.
Ориентационное взаимодействие наблюдается между полярными молекулами. Диполи разных молекул, совершая тепловое беспорядочное движение, при сближении ориентируются своими разноименными полюсами, в результате возникают ассоциаты.
Возникновение у неполярных молекул мгновенного диполя в каждый момент времени, вследствие несимметричного в данный момент расположения зарядов внутри молекулы, приводит к возникновению сил взаимодействия молекул, которые называются дисперсионными. Дисперсионная составляющая притяжения универсальна и присутствует всегда. Наиболее отчетливо дисперсионное притяжение проявляется при взаимодействии неполярных молекул и взаимодействии атомов благородных газов.
Ван-дер-ваальсовы силы значительно уступают по величине химическим силам, однако они обеспечивают относительно прочные связи. Ван-дер-ваальсовы силы - силы притяжения молекул друг к другу.
Билет№24. Классы неорганических соединений (оксиды, основания, кислоты, соли).
Билет№25. Получение и свойства кислот.
Билет№26. Получение и свойства оснований.
Билет№27. Получение и свойства солей.
Билет№28. Получение и свойства оксидов.
Билет№29. Термохимические расчеты в химических реакциях. Закон Гесса. Энтальпия.
В термодинамике весь объективный мир делится на систему и окружающую среду. Система – это некоторая часть материального мира, ограниченная реальной или воображаемой поверхностью. Система, у которой отсутствует обмен веществом с окружающей средой, называется закрытой, а если отсутствует также и обмен энергией – изолированной системой.
Совокупность всех свойств системы есть её состояние. Те свойства, которые задаются, называются параметрами состояния, а вычисляемые – функциями состояния. Внутренняя энергия U (кДж), энтальпия Н (кДж), энтропия S (Дж/К), энергия Гиббса G (кДж) обычно выступают в качестве функции состояния, и рассчитываются на один моль вещества, кДж/моль.
Химические процессы - это превращение одних веществ в другие. На разрыв связей в молекулах исходных веществ энергия затрачивается, а при образовании связей в молекулах продуктов реакции, энергия выделяется. Если общее количество затраченной энергии больше выделенной, то процесс идет с поглощением энергии и является эндотермическим (ΔН>0). Если же количество выделенной энергии больше затраченной, то процесс осуществляется с выделением энергии и является экзотермическим (ΔН<0).
Уравнения химических реакций, в которых указываются агрегатные состояния веществ, количества и тепловые эффекты, называются термохимическими. Для возможности сопоставления энергетических эффектов различных процессов их принято измерять в стандартных условиях: химически чистые вещества, при температуре 25°С (298 К) и давлении в 1 атм.
Тепловой эффект химической реакции при постоянном объёме (Qv) равен изменению внутренней энергии: Qv= - ΔU. Тепловой эффект реакции при постоянном давлении (QР) равен изменению энтальпии: QР= - ΔН. Энтальпию Н можно рассматривать, как энергию расширенной системы: Н = U + РV.
Тепловой эффект реакции образования одного моль сложного вещества из простых веществ в модификациях устойчивых в стандартных условиях, называется стандартной теплотой образования (стандартной энтальпией образования) данного вещества: ∆Hºобр (кДж/моль).
Закон Гесса: тепловой эффект химических реакций, протекающих при постоянном давлении или объеме, не зависит от пути протекания реакции и определяется состоянием исходных веществ и продуктов реакции. Из закона Гесса вытекают 5 следствий. Тепловой эффект химической реакции при стандартных условиях, как одно из следствий, равен разности сумм стандартных энтальпий образования продуктов реакции, и стандартных энтальпий образования исходных веществ, с учётом числа молей соответствующих веществ:
∆Hº = Σпрод ∆Hºобр.(прод.) – Σисх.∆Hºобр.(исх.)
где прод - количество вещества (моль) продукта реакции, исх - количество вещества (моль) исходных реагентов, ∆Hºобр.(прод.) и .∆Hºобр.(исх.)– энтальпии образования продуктов и исходных реагентов [кДж/моль], соответственно.
Билет№30. Понятие о термодинамических функциях (энтальпия, энтропия).
Билет№31. Энергия Гиббса и направление химических процессов.
В химических процессах одновременно действуют две силы: стремление частиц объединиться за счёт прочных связей, что уменьшает энтальпию системы ΔН<0, и стремление частиц разъединиться, что увеличивает энтропию ΔS>0. Энтропия S [Дж/(моль К)] является мерой свободы или мерой беспорядка. Две эти силы всегда направлены навстречу друг другу. При их равенстве система находится в равновесии. Результат действия энтальпийного (ΔН) и энтропийного (TΔS) факторов отражает термодинамический потенциал. В условиях постоянных температуры и давления этот потенциал называется энергией Гиббса G или изобарно–изотермическим потенциалом:
ΔG = ΔН – TΔS. Изменение энергии Гиббса (ΔG) является мерой самопроизвольного протекания химической реакции: реакция может протекать самопроизвольно в сторону уменьшения энергии Гиббса (ΔG=G2–G1<0) Как и в случае ΔН и ΔS изменение энергии Гиббса (ΔG) в результате химической реакции не зависит от пути процесса. Стандартное изменение энергии Гиббса (ΔGо) в ходе реакции равно:
∆Gº = Σпрод ∆Gºобр.(прод.) – Σисх ∆Gºобр.(исх.),
где ∆Gºобр.(прод.) и ∆Gºобр.(исх.) – стандартные энергии Гиббса образования продуктов и исходных реагентов [кДж/моль], соответственно.
Билет№32. Скорость реакции. Закон действующих масс для гомогенных и гетерогенных процессов.
Химическая кинетика – учение о скорости и механизме химических реакций. При рассмотрении вопроса о скорости реакций необходимо различать реакции, протекающие в гомогенной системе, и реакции, протекающие в гетерогенной системе. Гомогенная система состоит из одной фазы, а гетерогенная – из нескольких фаз. Фазой называется часть системы, отделённая от других частей поверхностью раздела, при переходе через которую свойства изменяются скачком. В гомогенной системе реакция протекает по всему объёму, в гетерогенной системе – на границе раздела фаз. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции, за единицу времени в единице объёма системы. То есть скорость гомогенной реакции (υгомоген) определяется как изменение концентрации (ΔС) реагирующих веществ за единицу времени (Δτ). Средняя скорость реакции – величина положительная:
υгомоген = ± Δn/(Δτ·V) = ± ΔC/Δτ, [моль/(л·с)], где Δn – количество вещества, моль; Δτ - время реакции, с; V - объем реакционной смеси, л; ΔC - изменение молярной концентрации, [моль/л].
Скоростью гетерогенной реакции (υгетерог) называется количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности раздела фаз:
υгетерог = ±Δn/(Δτ·S), [моль/(с·м2)], где S - площадь поверхности раздела фаз, м2.
К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, природа растворителя, присутствие в системе катализаторов или ингибиторов. Скорость химической реакции пропорциональна числу соударений, которое тем больше, чем выше концентрация исходных веществ. Влияние концентрации реагирующих веществ на скорость реакции выражается законом действия масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, в степенях, численно равных коэффициентам в уравнении реакции. Таким образом, выражение для скорости реакции в соответствии с законом действия масс для процесса:Н2 + С12 = 2НС1 будет иметь вид: υ = k[H2]·[Cl2], где [H2] и [Cl2] - молярные концентрации H2 и Cl2 [моль/л], соответственно. Если реагенты газообразны, то вместо молярных концентраций в расчетах могут быть использованы величины парциальных давлений (Р(H2)·и Р(Cl2)) исходных газов: υ = k1Р(H2)·Р(Cl2), где k и k1-коэффициенты пропорциональности или константы скорости химической реакции. Физический смысл этой величины раскрывается при равенстве концентраций исходных веществ 1 [моль/л], тогда υ = k, то есть k – удельная скорость. Поэтому чаще скорость реакции оценивается по величине k. Для гетерогенной реакции в выражение закона действия масс входят величины концентраций только газообразных или растворённых веществ. Например, для реакции: 2С(тв.) + О2 = 2СО, υ = k·[O2], где ·[O2] - молярная концентрация [моль/л].
Билет№33. Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа.
Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на 10°С скорость большинства химических реакций увеличивается в 2-4 раза:
 ,
где υ2
и υ1
– скорости реакции при температурах
T2
и T1,
соответственно; γ – температурный
коэффициент скорости реакции (для
большинства реакций он равен от 2 до 4).
Более точно зависимость константы
скорости от температуры описывается
уравнением
Аррениуса:
k
= A·exp-Eа/RT,
где k – константа скорости реакции, А –
предэкспоненциальная постоянная, Ea
– энергия активации для данного процесса,
R
- универсальная газовая постоянная, T
- температура, K.
,
где υ2
и υ1
– скорости реакции при температурах
T2
и T1,
соответственно; γ – температурный
коэффициент скорости реакции (для
большинства реакций он равен от 2 до 4).
Более точно зависимость константы
скорости от температуры описывается
уравнением
Аррениуса:
k
= A·exp-Eа/RT,
где k – константа скорости реакции, А –
предэкспоненциальная постоянная, Ea
– энергия активации для данного процесса,
R
- универсальная газовая постоянная, T
- температура, K.
Билет№34. Понятие об энергии активации. Влияние катализатора.
Всякая химическая реакция протекает через образование некоторого активного комплекса, который затем распадается на продукты реакции. В неустойчивом промежуточном – переходном или активном комплексе - старые связи еще не полностью разорвались, а новые еще не вполне образовались, ему соответствует такое состояние системы, при котором энергия максимальна. Для перехода системы в активный комплекс нужна энергия, равная энергии активации. Энергия активации – избыточная энергия, которой должны обладать молекулы, для того, чтобы их столкновение могло привести к образованию нового вещества; это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции. Катализатор – вещество, которое увеличивает скорость реакции, но при этом не расходуется в результате протекания процесса. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. Ингибитор – замедляет реакцию, в его присутствии энергия активации увеличивается. Реакции, протекающие под действием катализаторов, называются каталитическими. Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной отдельной фазы.
Билет№35. Химическое равновесие. Константа химического равновесия.
Константа
равновесия - характерная величина для
каждой обратимой химической реакции.
Для
гомогенной реакции в
общем виде: a
A
+ b
B
 c
C
+ d
D
c
C
+ d
D
в состоянии равновесия скорости прямой (υ1) и обратной (υ2) реакций равны:
υ1 = υ2; υ1 = k1 [A]a∙[B]b; υ2 = k2 [C]c∙[D]d.
Тогда константа химического равновесия имеет вид:
Кр = k1/k2 = ([C]c∙[D]d)/([A]a∙[B]b), где [A], [B], [C],∙[D] – равновесные молярные концентрации веществ A, B, C и∙D, [моль/л] соответственно.
В выражение для константы равновесия входят равновесные молярные концентрации. Константа равновесия – отношение констант прямой (k1) и обратной (k2) реакций: k1/k2= Кр. Она зависит от температуры и природы реагирующих веществ, но не зависит от концентраций.
Равновесие
в
гетерогенных системах.
Так как концентрации твердых фаз не
входят в уравнение скорости реакции,
то они не будут входить в уравнение
константы равновесия гетерогенных
обратимых систем. Например, для реакции:
СаСО3(тв)
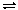 СаО(тв)
+СО2(г)
константа
химического равновесия рассчитывается
по формуле: Кр
= [СО2].
СаО(тв)
+СО2(г)
константа
химического равновесия рассчитывается
по формуле: Кр
= [СО2].
Билет№36. Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье.
Процесс изменения равновесных концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Воздействием различных внешних факторов можно добиться смещения равновесия в нужном направлении. Равновесие смещается в соответствие с принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
1)
При
увеличении концентрации какого-либо
из веществ, участвующих в реакции,
равновесие смещается в сторону расхода
этого вещества; при уменьшении концентрации
какого-либо из веществ равновесие
смещается в сторону образования этого
вещества. Рассмотрим
реакцию 2СО + О2
 2СО2.
Введем в систему дополнительно некоторое
количество угарного газа СО. Согласно
закону действия масс: υ1
= k1[СО]2∙[О2],
увеличение концентрации СО повлечет
за собой увеличение скорости прямой
реакции, тогда как скорость обратной
реакции не изменится. В прямом направлении
реакция теперь будет протекать быстрее,
чем в обратном. В результате этого
концентрации СО и О2
будут уменьшаться.
2СО2.
Введем в систему дополнительно некоторое
количество угарного газа СО. Согласно
закону действия масс: υ1
= k1[СО]2∙[О2],
увеличение концентрации СО повлечет
за собой увеличение скорости прямой
реакции, тогда как скорость обратной
реакции не изменится. В прямом направлении
реакция теперь будет протекать быстрее,
чем в обратном. В результате этого
концентрации СО и О2
будут уменьшаться.
2)
При
увеличении давления путем сжатия
системы, равновесие сдвигается в сторону
уменьшения числа молекул газов, т.е. в
сторону понижения давления; при уменьшении
давления равновесие сдвигается в сторону
возрастания числа молекул газов, т.е. в
сторону увеличения давления. Рассмотрим
влияние давления на реакцию N2O4(г)
 2NO2(г).
2NO2(г).
В состоянии равновесия концентрации газов имеют равновесные значения [NO2] и [N2O4], а скорости прямой (υ1) и обратной (υ2) реакций определялись уравнениями: υ1 = k1·[N2O4] и υ2 = k2·[NO2]2. Не изменяя температуры, уменьшим в 2 раза объем системы. В первый момент парциальные давления и концентрации всех газов возрастут вдвое, но при этом изменится соотношение между скоростями прямой и обратной реакций:
υ1' = k1·2[N2O4] = 2υ1 и υ2' = k2·(2[NO2])2 = 4υ2. Таким образом, в результате увеличения давления скорость прямой реакции возросла только в 2 раза, а обратной - в 4 раза. Равновесие в системе нарушается, и обратная реакция будет преобладать над прямой – равновесие сместится влево, в сторону образования дополнительных количеств исходных реагентов.
3) Нарушение равновесия вследствие изменения температуры, определяется знаком теплового эффекта реакции: при повышении температуры равновесие смещается в направлении эндотермической (ΔH>0), а при понижении – в направлении экзотермической реакции (ΔH<0).
Билет№37. Способы выражения состава растворов (концентрация растворов)
Раствор - это твердая, жидкая или газообразная гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Всякий раствор состоит из растворенных веществ и растворителя, т. е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить дополнительное количество данного вещества, ненасыщенным.
Концентрацию растворов можно выражать следующими способами:
Процентная концентрация по массе (ω, %) - число единиц массы (например, число граммов) растворенного вещества (mр.в.), содержащихся в 100 единицах массы (например, в 100 граммах) раствора (mр-ра):
ω= (mр.в.·100%)/mр-ра. Например, 15% раствор хлорида натрия – это такой раствор, в 100 г которого содержится 15 г NaCl и 85 г воды.
Молярность (См) - число моль (n) растворенного вещества, содержащихся в 1 л раствора: См = n/V. Так, 2М H2SO4 обозначает раствор серной кислоты, в каждом литре которого содержится два моля H2SO4, 196 г.
Молярная концентрация эквивалента (нормальность) (Сн): - число моль эквивалентов (nэкв) растворенного вещества, содержащихся в одном литре раствора: Так, 2н. H2SO4 означает раствор серной кислоты, в каждом литре которого содержится два эквивалента, т. е. 98 г H2SO4.
Моляльность (Сm) - число моль растворенного вещества, приходящихся на 1000 г растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000 г воды приходится два моля H2SO4. Мольно-массовая концентрация раствора – моляльность, в отличие от его молярности, не изменяется при изменении температуры.
Мольная доля (Ni) - отношение числа молей данного вещества (n1) к общему числу молей всех веществ (n1, n2), имеющихся в растворе: N1=n1/(n1+n2).
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка:
СН1V1= СН2V2, где СН1, СН2 – молярные концентрации эквивалента (моль) растворенного вещества 1 и 2, соответственно; V1, V2 – объемы растворов (л) 1 и 2, соответственно. Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальностям.
Билет№38. Общие свойства растворов неэлектролитов (Δtкип., Δtзам., осмос.).
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества (закон Рауля, 1887 г.): N2 = [(Pо - P) / Pо], где N2 - мольная доля растворённого вещества; P0 - давление насыщенного пара растворителя над чистым растворителем (кПа), P - давление насыщенного пара растворителя над раствором (кПа).
Односторонняя диффузия растворителя в раствор через полупроницаемую перегородку называется осмосом. Объём раствора в результате осмоса увеличивается, при этом возникает давление на стенки сосуда, в котором находится раствор. Это давление называется осмотическим (Pосм,, кПа): Pосм = i·См·R·T, где См – молярная концентрация, R – универсальная газовая постоянная, T – температура, К
Изотонический коэффициент i (коэффициент Вант-Гоффа) - поправочный коэффициент, отражающий увеличение числа частиц в растворах электролитов по сравнению с растворами неэлектролитов той же концентрации.
Криоскопия - физико-химический метод исследования жидких растворов нелетучих веществ, основанный на измерении понижения температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя. Понижение температуры (Δtзам) замерзания раствора:
Δtзам = i·K·Cm, где К - криоскопическая постоянная растворителя - величина понижения температуры замерзания раствора, в котором содержится 1 моль растворенного вещества в 1 кг растворителя, Cm - моляльная концентрация раствора.
Эбуллиоскопия - метод изучения жидких растворов нелетучих веществ, основанный на измерении повышения температуры кипения раствора по сравнению с температурой кипения чистого растворителя. Повышение температуры кипения (Δtкип) раствора: Δtкип = i·E·Cm, где Е - эбуллиоскопическая постоянная (константа) растворителя — величина повышения температуры кипения раствора, в котором содержится 1 моль растворенного вещества в 1 кг растворителя. Изотонический коэффициент (i) связан со степенью диссоциации (α) электролита соотношением: α =[(i - 1) / (k - 1)], где k — число ионов, на которые распадается при диссоциации молекула электролита (для KCl k=2, для ВаС12 и Na2SO4 k = 3 и т. д.).
Билет№39. Электролитическая диссоциация. Сильные и слабые электролиты. Степень диссоциации
П о
способности проводить электрический
ток все вещества делятся на электролиты
(проводящие электрический ток) и
неэлектролиты (непроводящие электрический
ток). Электролиты
- вещества,
обладающие ионной проводимостью; их
называют проводниками второго рода –
прохождение тока через них сопровождается
переносом вещества. К электролитам
относится большинство неорганических
кислот, оснований и солей. В среде высокой
диэлектрической проницаемости (спирты,
вода и др.) они распадаются на ионы.
Процесс распада молекул на ионы называется
электролитической
диссоциацией: NaCl
о
способности проводить электрический
ток все вещества делятся на электролиты
(проводящие электрический ток) и
неэлектролиты (непроводящие электрический
ток). Электролиты
- вещества,
обладающие ионной проводимостью; их
называют проводниками второго рода –
прохождение тока через них сопровождается
переносом вещества. К электролитам
относится большинство неорганических
кислот, оснований и солей. В среде высокой
диэлектрической проницаемости (спирты,
вода и др.) они распадаются на ионы.
Процесс распада молекул на ионы называется
электролитической
диссоциацией: NaCl
 Na+
+
Cl.
Диссоциация электролитов на ионы
сопровождается сольватацией, т.е.
взаимодействием ионов с полярными
молекулами растворителя. Если растворителем
является вода, то термин сольватация
заменяется термином гидратация.
Na+
+
Cl.
Диссоциация электролитов на ионы
сопровождается сольватацией, т.е.
взаимодействием ионов с полярными
молекулами растворителя. Если растворителем
является вода, то термин сольватация
заменяется термином гидратация.
Количественной характеристикой процесса диссоциации является степень диссоциации (), которая показывает отношение числа молекул, распавшихся на ионы (Nион), к общему числу растворенных молекул (Nобщ):
= Nион / Nобщ. По степени диссоциации электролиты делятся на:
1) Сильные, которые в 0,1 М растворе имеют >30%. К ним относятся: почти все соли (кроме HgCl2, СdCl2, Fe(SCN)3, Pb(CH3COO)2 и некоторые другие); сильные минеральные кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4); основания щелочных (LiOH, NaOH, KOH, RbOH, CsOH, FrOH) и щелочно-земельных металлов(Ca(OH)2, Sr(OH)2, Ba(OH)2).
2) Средние ( = 3 - 30 % в 0,1 М растворах). К ним относятся, например, H3PO4, H2SO3, HF, Mg(OH)2.
3) Слабые ( < 3 % в 0,1 М растворах). Слабыми электролитами являются H2S, H2CO3, HNO2, HCN, H2SiO3, H3BO3, HClO и др., а также большинство оснований многовалентных металлов, NH4OH и вода.
Сильные электролиты практически нацело диссоциируют на ионы, и этот процесс можно изобразить следующим образом:
H Cl H+ + Cl ; Na2SO4 2Na+ + SO42
Билет№40. Диссоциация слабых кислот и оснований. Константа диссоциации
Билет№41.Закон разведения Оствальда. Диссоциаци в растворах слабых электр-ов.
Слабые электролиты диссоциируют частично и обратимо. В их растворах преобладают не ионы, а молекулы. К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать константу равновесия, которая называется константой диссоциации (КД) и приводится в таблицах. Константа диссоциации характеризует силу электролита: чем больше величина КД., тем сильнее электролит, и наоборот.
H NO2
H+
+ NO2–
(уравнение электролитической
диссоциации)
NO2
H+
+ NO2–
(уравнение электролитической
диссоциации)

 1,
где [H+],
[NO2-],
[HNO2]
– молярные равновесные концентрации
соответствующих частиц в растворе, КД
–
константа диссоциации азотистой кислоты
HNO2
1,
где [H+],
[NO2-],
[HNO2]
– молярные равновесные концентрации
соответствующих частиц в растворе, КД
–
константа диссоциации азотистой кислоты
HNO2
Равновесия в слабых электролитах подчиняются закону разведения Оствальда. Если общая молярная концентрация слабого электролита, например, слабой кислоты HNO2 равна С (моль/л), тогда концентрация ионов H+ и NO2- будет определяться выражением [H+] = [NO2-] = С· (моль/л), а концентрация недиссоциированного электролита [HNO2] = (С-С·).
Тогда:
 .
При
<< 1 получим: КД
= С.2
и
.
При
<< 1 получим: КД
= С.2
и

Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, присутствия в растворе одноименных ионов, температуры. Для одного и того же электролита при данной температуре степень диссоциации () увеличивается с разбавлением раствора; при больших разбавлениях электролит полностью диссоциирует (1). С увеличением температуры также увеличивается.
Билет№42. Электролитическая ионизация воды. Водородный показатель.
Вода в очень малой степени находится в диссоциированном состоянии (очень слабый электролит): H2O H+ + OH –
К её диссоциации можно применить закон
действующих масс:
её диссоциации можно применить закон
действующих масс:
При
столь малой константе диссоциации (КД),
концентрация воды остается практически
неизменной и равной: [H2O]=1000/18=55.6
моль/л. Произведение постоянных величин
также постоянная величина: Kд∙[H2O]
= [H+]∙[OH–].
 Таким
образом, произведение молярных
концентраций ионов водорода [H+]
и гидроксильных групп [OH–]
в любом водном растворе есть величина
постоянная (при данной температуре) и
называется ионным
произведением воды (КВ).
Диссоциация воды – процесс эндотермический,
поэтому ионное произведение воды (КВ)
зависит от температуры. С
повышением температуры увеличивается
концентрация [H+]
и [OH–]
ионов и величина ионного произведения:
так, при 100оС:
КВ
= [H+][OH–]
= 59∙10-14
, при 0оС:
КВ
= [H+][OH–]
= 0,139∙10-14.
Таким
образом, произведение молярных
концентраций ионов водорода [H+]
и гидроксильных групп [OH–]
в любом водном растворе есть величина
постоянная (при данной температуре) и
называется ионным
произведением воды (КВ).
Диссоциация воды – процесс эндотермический,
поэтому ионное произведение воды (КВ)
зависит от температуры. С
повышением температуры увеличивается
концентрация [H+]
и [OH–]
ионов и величина ионного произведения:
так, при 100оС:
КВ
= [H+][OH–]
= 59∙10-14
, при 0оС:
КВ
= [H+][OH–]
= 0,139∙10-14.
В соответствии с теорией электролитической диссоциации ионы H+ являются носителями кислотных свойств, а ионы OH– - носителями основных свойств. Поэтому раствор будет нейтральным, при условии: [H+] = [OH–] =
10–7 моль/л; при [H+] > [OH–] – кислым; при [H+] < [OH–] – щелочным.
Концентрация катионов водорода [H+] обычно выражается очень малыми величинами. Для большего удобства принято пользоваться отрицательным значением десятичного логарифма молярной концентрации ионов [H+], который назван водородным показателем, и обозначается рН:
рН = –lg [H+], где [H+] - молярная концентрация ионов H+. Следовательно: [H+]= 10–pH
Если реакция среды нейтральная, то [H+] = 10–7 [моль/л], и рН=7. Если реакция среды кислая, то [H+]>10–7 [моль/л], и рН<7. Если среда щелочная, то [H+]<10–7 [моль/л], и рН>7. По аналогии рН введен гидроксильный показатель (рОН):
рОН = –lg [ОH-], где [ОH-] - молярная концентрация ионов ОH-. А также показатель константы воды: рКВ = –lg КВ . Логарифмируя ионное произведение воды получаем выражение: –lg [H+][OH–] = –lg 10–14 и далее: pH + pOH = 14.
Кислота (определение по Аррениусу) – это химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительные ионы водорода и отрицательные ионы кислотного остатка.
Билет№43. Расчет рН для слабых кислот и оснований
а) Поскольку диссоциация сильной кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4) протекает практически полностью можно считать: [H+] = Скисл., где Скисл - молярная концентрация кислоты.
H NO3
NO3
 H+
+
NO3–
(сильная кислота - сильный электролит)
H+
+
NO3–
(сильная кислота - сильный электролит)
Расчет рН сильной кислоты проводят по уравнению:
рН = - lgаН+ = - lgfН+[H+], где аН+ - активная концентрация, моль/л.
б) При расчете рН слабых электролитов обычно принимают ионную силу раствора (I) равной нулю, коэффициент активности (f) равным 1 и рН = - lg[H+].
H NO2 H+ + NO2– (слабая кислота - слабый электролит)
Концентрация ионов водорода в растворе слабых кислот определяют по закону разведения Оствальда:
 ,где
α – степень диссоциации кислоты, Скисл
– молярная концентрация кислоты, Ккисл
– константа диссоциации кислоты,
характеризует силу кислоты: чем меньше
константа диссоциации, тем слабее
кислота.
,где
α – степень диссоциации кислоты, Скисл
– молярная концентрация кислоты, Ккисл
– константа диссоциации кислоты,
характеризует силу кислоты: чем меньше
константа диссоциации, тем слабее
кислота.
Основание (определение по Аррениусу) - это химическое соединение, которое в водном растворе частично или полностью диссоциирует на положительно заряженные ионы (простые или сложные) и отрицательно заряженные гидроксид-ионы.
Билет№44. Реакции в растворах электролитов. Направление ионно-обменных реакций.
В водных растворах электролитов химические реакции протекают с участием ионов, такие реакции называются ионно-обменными, а уравнения этих реакций – ионными уравнениями.
В ионных уравнениях реакций формулы сильных электролитов записываются в виде ионов, формулы слабых электролитов, осадков и газов – в виде молекул.

