
- •Квантовые числа для электрона в атоме:
- •Направление ионно-обменной реакции между двумя электролитами в растворе определяется возможностью образования их ионами осадка, газа или слабого электролита.
- •Степень гидролиза соли определяется следующими факторами.
- •К основным методам защиты от коррозии относятся:
- •Типы гетерогенных дисперсионных систем
К основным методам защиты от коррозии относятся:
1) Защитные покрытия металлов. Покрытия подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла. Основная цель защитных покрытий – изолировать металл от воздействия агрессивной среды. Для металлических покрытий обычно применяют металлы, которые образуют на своей поверхности защитные пленки (Al, Cr, Zn, Cd, Ni и др.). Металлические покрытия подразделяют на катодные (металл покрытия менее активный) и анодные (металл покрытия более активный). К неметаллическим покрытиям относятся покрытия красками, лаками, эмалями, минеральными маслами, битумом; металлокерамические и резиновые покрытия. К химическим покрытиям относятся искусственно создаваемые защитные пленки различного состава (оксидные, фосфатные, хроматные, сульфидные и пр.), вызывающие пассивирование поверхности металлов.
2) Применение коррозионно-стойких материалов.
3) Обработка коррозионной среды реагентами. В роли реагентов, замедляющих коррозию, выступают ингибиторы. В зависимости от природы металла и окружающей среды применяются различные ингибиторы.
4) Электрохимические методы защиты металлических изделий подразделяются на протекторную, катодную, электродренажную и анодную защиты. Протекторная защита заключается в присоединении к защищаемому сооружению более активного металла,который выполняет роль протектора и разрушается, а металлическая конструкция (катод) сохраняется. Протектор периодически возобновляется в связи с его растворением. При катодной защите защищаемая конструкция присоединяется к отрицательному полюсу источника электрического тока. При электродренажной защите блуждающие токи с защищаемого трубопровода отводятся с помощью электродренажной установки к рельсовой сети (источнику блуждающих токов). Смысл анодной защиты заключается в создании на поверхности защищаемой конструкции пассивирующей пленки с помощью анодной поляризации от внешнего источника постоянного тока, то есть переводом металла в устойчивое пассивное состояние.
Билет№57. Электролиз расплава солей. Потенциал разложения
Электролиз - окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Химические реакции, протекающие при электролизе, осуществляются при помощи энергии электрического тока, подведённого извне. Следовательно, при электролизе происходит преобразование электрической энергии в химическую. Процессы окисления и восстановления в этом случае протекают раздельно, т.е. на различных электродах. Электрод, на котором происходит восстановление, называется катодом, а электрод, на котором происходит окисление, - анодом. Катод подключён к отрицательному полюсу, и поэтому к нему движутся катионы, анод – к положительному полюсу, к нему движутся анионы. Минимальный потенциал (В), при котором процесс электролиза становится возможным, называется потенциалом (напряжением) разложения. Его находят вычитанием электродного потенциала катиона из соответствующего значения электродного потенциала аниона, единица измерения Вольт (В).
Электролиз расплава. Рассмотрим электролиз расплава СuCl2, который диссоциирует на ионы Сu2+ и Cl⁻. При подключении напряжения к электродам через расплав начинает протекать электрический ток. Так, при электролизе расплава хлорида меди (II) электродные процессы могут быть выражены полуреакциями:
на катоде (–): Сu2+ + 2e → Cu0 – катодное восстановление
на аноде (+): 2 Cl– – 2e → Cl2 – анодное окисление
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением:
Cu2+ + 2 Cl– → Cu + Cl2
Билет№58. Электролиз растворов солей на инертных электродах
В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом (растворимым). Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза.
Таблица 1 - Процессы, происходящие на катоде
Электрохимический ряд напряжений металлов |
|||
Li, K, Ca, Na, Mg, Al |
Mn, Zn, Fe, Ni, Sn, Pb |
H |
Cu, Hg, Ag, Pt, Au |
Меn⁺не восстанавливается (остаётся в растворе) 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ |
Меn⁺ + nē = Me° 2 H₂O + 2ē = H₂↑ + 2 OH⁻ |
|
Men⁺ + nē = Me° |
Билет№59. Электролиз растворов солей на активных анодах.
Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще применяют графит, уголь, платину; для активных – медь, цинк, алюминий и т.д. (таблица 2).
Таблица 2 - Процессы, происходящие на аноде
Анод |
Кислотный остаток Аm⁻ |
|
бескислородный |
кислородсодержащий |
|
Нерастворимый (инертный) уголь, графит, платина, золото |
J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻) Аm⁻ – m ē = A° |
OH⁻, SO₄²⁻, NO₃⁻, F⁻ В щелочной среде: 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺ |
Растворимый (металлы средней активности) |
Окисление металла - анода (анод): Ме° – nē = Men⁺ (раствор) |
|
В случае электролиза растворов возможны конкурирующие реакции. Критерием, определяющим преимущество того или иного электродного процесса, служит величина его электродного потенциала. Чем выше потенциал, тем легче происходит восстановление на катоде и труднее осуществляется окисление на аноде.
Билет№60. Применение электролиза.
Электрохимические процессы широко применяются в различных областях современной техники, в аналитической химии, биохимии и т. д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д. При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др. ), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др. ). Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов. Электролиз может осуществляться с растворимыми анодами - процесс электрорафинирования или с нерастворимыми - процесс электроэкстракции. Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах. В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки. Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др. Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов в электролизер. При пропускании тока металл, подлежащий очистке, подвергается анодному растворению, т. е. переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде, благодаря чему образуется компактный осадок уже чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми, либо переходят в электролит и удаляются. Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника пожразделяется на гальваностегию и гальванопластику. Гальваностегия (от греч. покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается (сцепляется) с покрываемым металлом (предметом), служащим катодом электролизера. Перед покрытием изделия необходимо его поверхность тщательно очистить (обезжирить и протравить), в противном случае металл будет осаждаться неравномерно, а кроме того, сцепление (связь) металла покрытия с поверхностью изделия будет непрочной. Способом гальваностегии можно покрыть деталь тонким слоем золота или серебра, хрома или никеля. С помощью электролиза можно наносить тончайшие металлические покрытия на различных металлических поверхностях. При таком способе нанесения покрытий, деталь используют в качестве катода, помещенного в раствор соли того металла, покрытие из которого необходимо получить. В качестве анода используется пластинка из того же металла.
Гальванопластика – получение путем электролиза точных, легко отделяемых металлических копий относительно значительной толщины с различных как неметаллических, так и металлических предметов, называемых матрицами. С помощью гальванопластики изготовляют бюсты, статуи и т. д. Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование "накладного" слоя никеля, серебра, золота и т. д. ).
Кроме указанных выше, электролиз нашел применение и в других областях:
получение оксидных защитных пленок на металлах (анодирование);
электрохимическая обработка поверхности металлического изделия (полировка);
электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др. );
очистка воды – удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т. д. ).
Билет№61. Жесткость воды, единица жесткости, способы удаления жесткости воды
Жесткость воды обусловливается наличием в ней ионов Са2+ и Mg2+. Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са2+ или
12,16 мг/л ионов Mg2+. Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Ca(HCO3)=CaCO3↓+H2O+CO2↑
2Mg(HCO3)2=(MgOH)2CO3↓+3CO2↑+H2O
Таким образом, при кипячении карбонатная жесткость устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3– в CO32– и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са2+, Mg2+, CO32–, соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянная) жесткость не разрушается кипячением. Она обусловливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом сульфатов и хлоридов.
Общая жесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
очень мягкие (<1,5 мг-экв/л), мягкие (1,5-3,0 мг-экв/л), средней жесткости (3,0-5,4 мг-экв/л), жесткие (5,4-10,7 мг-экв/л), очень жесткие (>10,7 мг-экв/л).
Если известны концентрации (мг/л) в воде Ca2+, Mg2+ и HCO3–, то жесткость рассчитывается по следующим формулам:
Общая
жесткость

Карбонатная жесткость равна концентрации (мг/л) [HCO3–]; в случае, если содержание ионов кальция и магния в воде выше, чем количество гидрокарбонатов:
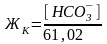 ,
где 61,02 – эквивалентная масса иона
HCO3–.
,
где 61,02 – эквивалентная масса иона
HCO3–.
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК = ЖО – ЖК . Следовательно, ЖНК – это содержание Ca2+ и Mg2+, эквивалентное концентрации всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Билет№62. Классификация дисперсных систем
Дисперсные системы – гетерогенные системы, состоящие из сплошной непрерывной фазы – дисперсионной среды, и находящихся в ней раздробленных частиц того или иного размера и формы – дисперсной фазы.
Количественной характеристикой дисперсности (раздробленности) вещества является степень дисперсности (Д): Д = 1/a, где a – размеры частиц.
По степени дисперсности все дисперсные системы можно разделить на три группы:
Грубодисперсные (взвеси) – размеры частиц 10-5-10-7 м;
Коллоидные растворы (золи) – размеры частиц 10-7-10-9 м;
Истинные растворы – размеры частиц менее 10-9м.
Трем возможным агрегатным состояниям дисперсной фазы и дисперсионной среды соответствуют следующие типы гетерогенных дисперсионных систем.
