
- •1. Основные определения и понятия термодинамики
- •2. Параметры состояния и уравнения состояния.
- •3.Термодинамическая работа, координаты p-V
- •4. Потенциальная (техническая) работа
- •5. Теплоемкость. Определение теплоемкости веществ.
- •Вопрос 8. Определение температуры смеси. Теплоемкость смеси
- •Вопрос 9. Термодинамические условия фазовых переходов.
- •Вопрос 10. Критические параметры чистого вещества и смесей.
- •Вопрос 11. Теория соответственных состояний. Коэффициент сжимаемости.
- •13. Аналитическое выражение первого начала термодинамики
- •14. Первое начало термодинамики для идеального газа.
- •1 5. Принцип существования энтропии идеального газа.
- •31. Теплопроводность. Закон Фурье. Коэффициент теплопроводности
- •32. Дифференциальное уравнение теплопроводности. Условия однозначности
- •39. Теплообмен излучением. Основные законы.
- •40. Теплообмен излучением между телами.
- •42. Сложный теплообмен (теплопередача)
- •43. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопередачи.
- •44. Теплопередача через плоскую однослойную и многослойную плоскую стенку
- •45. Теплопередача через криволинейные однослойные и многослойные стенки.
- •48. Теплопередача при переменных температурах. Средняя разность температур.
- •49. Тепловой баланс теплообменного аппарата и частные случаи.
- •50.Средняя разность температур для сложных схем теплообмена
- •51.Обобщенные уравнения теплопередачи при переменных температурах
- •52. Расчет теплообменный аппаратов первого рода.
- •53. Расчет теплообменный аппаратов второго рода.
- •54. Круговые процессы. Кпд и холодильный коэффициент.
- •55. Обратимый цикл Карно.
- •56. Математическое выражение второго начала термостатики. Основные следствия.
- •57. Математическое выражение второго начала термодинамики. Основные следствия.
- •58. Истечение жидкостей и газов. Основные расчётные соотношения.
- •59.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •60.Переход через критическую скорость (сопло Лаваля).
- •61. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •62. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •63. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •64.Классификация гту:
- •72. Паросиловые установки, цикл Ренкина, методы повышения кпд.
- •73.Схема,рабочий процесс и цикл паросиловой установки с промежуточным перегревом
- •74.Схема,рабочий процесс и цикл паросиловой установки с регенерацией
- •76.Рабочий процесс парокомпрессионной холодильной установки:
- •77. Воздушные холодильные машины.
- •78.Абсорбционная холодильная установка
- •79.Схема,рабочий процесс и цикл теплового насоса
- •82. Индикаторные и эффективные характеристики двигателей внутреннего сгорания
5. Теплоемкость. Определение теплоемкости веществ.
Теплоемкостью называется количество теплоты, которое надо сообщить единице массы, количества или объема вещества, чтобы его температура повысилась на 1 градус.
Различают
массовую теплоемкость
с,
измеряемую в Дж/(кгК),
молярную
![]() – Дж/(кмольК)
и объемную с'
– Дж/(м3К).
– Дж/(кмольК)
и объемную с'
– Дж/(м3К).
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
![]() ;
;
![]() .
(1.12)
.
(1.12)
Теплоемкость газов зависит от термодинамического процесса, в котором подводится или отводится теплота. Если процесс задан условием z = idem, то теплоемкость в этом процессе будет определяться следующим образом:
![]() .
- Эта теплоемкость называется
истинной.
.
- Эта теплоемкость называется
истинной.
Экспериментальное определение теплоемкости проводится в двух процессах: при постоянном объеме (изохорная теплоемкость cv ) и постоянном давлении (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением
![]() .
.
![]() .
.
Для некоторых газов в определенном интервале температур истинная теплоемкость изменяется по линейному закону
![]() .
.
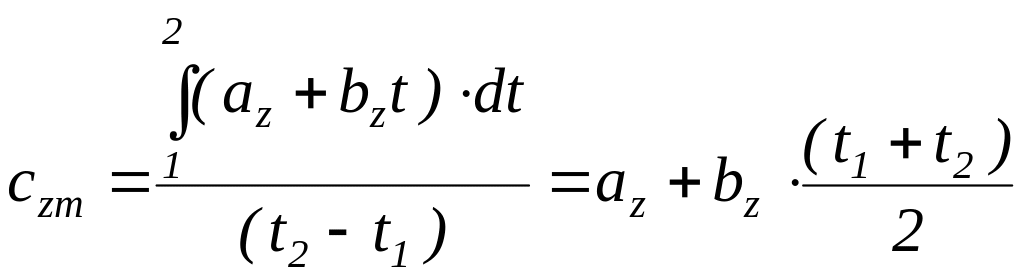 ,
(1.17)
,
(1.17)
где сzm - называется первой средней теплоемкостью. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
6-7. Смеси жидкостей, паров и газов, расчет характеристик смеси веществ. Схемы смещения.
Термодинамическая смесь
– система, состоящая из
![]() химически невзаимодействующих друг с
другом компонентов.
химически невзаимодействующих друг с
другом компонентов.
Состав смеси задаётся либо
массовой концентрацией компонентов -
![]() ,
либо молярным составом -
,
либо молярным составом -
![]() (объёмный).
(объёмный).
![]() ,
где
,
где
![]() - масса одного компонента смеси,
- масса одного компонента смеси,
![]() - масса всей смеси
- масса всей смеси
![]()
![]()
![]()
![]() - число Кмолей вещества,
- число Кмолей вещества,
![]() - число Кмолей смеси
- число Кмолей смеси
.
![]()
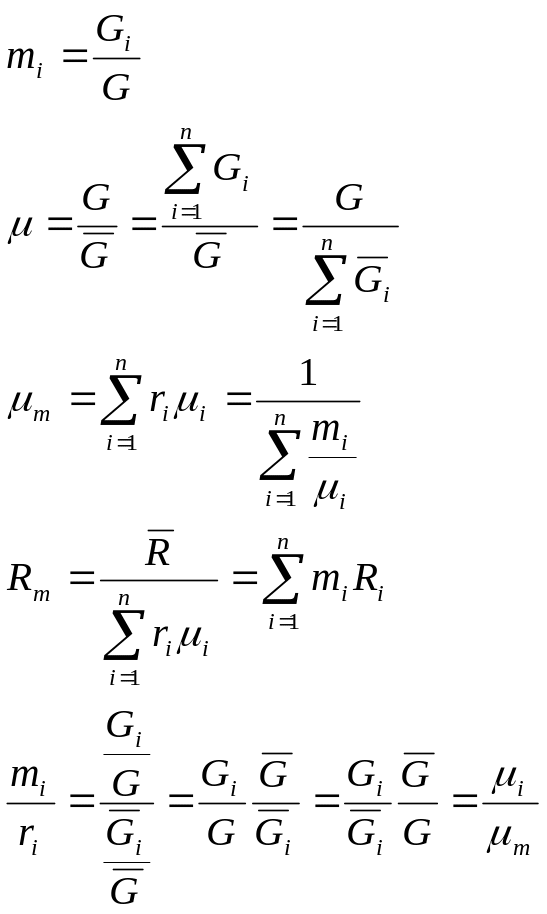
Если смесь является идеальным
газом, то
![]() .
.
Если смесь является реальным
газом, то
![]() .
.
Псевдокритические параметры:
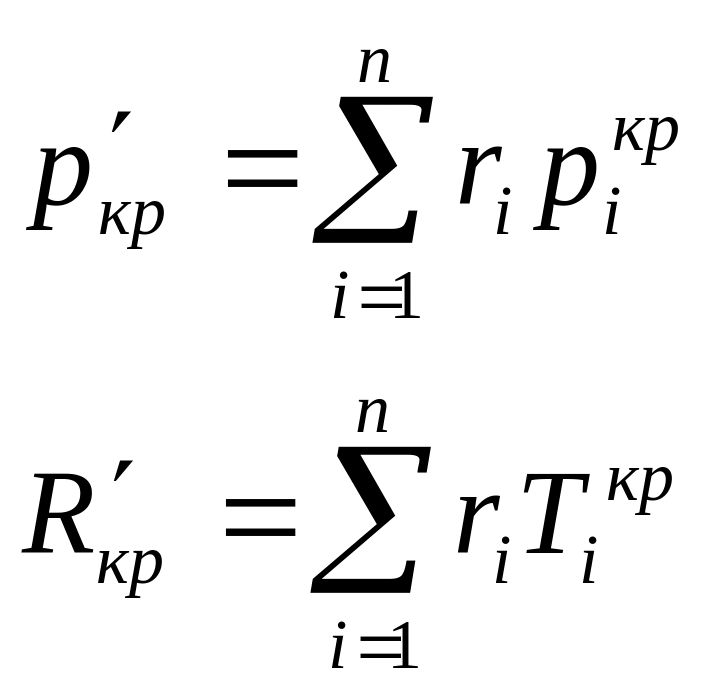
С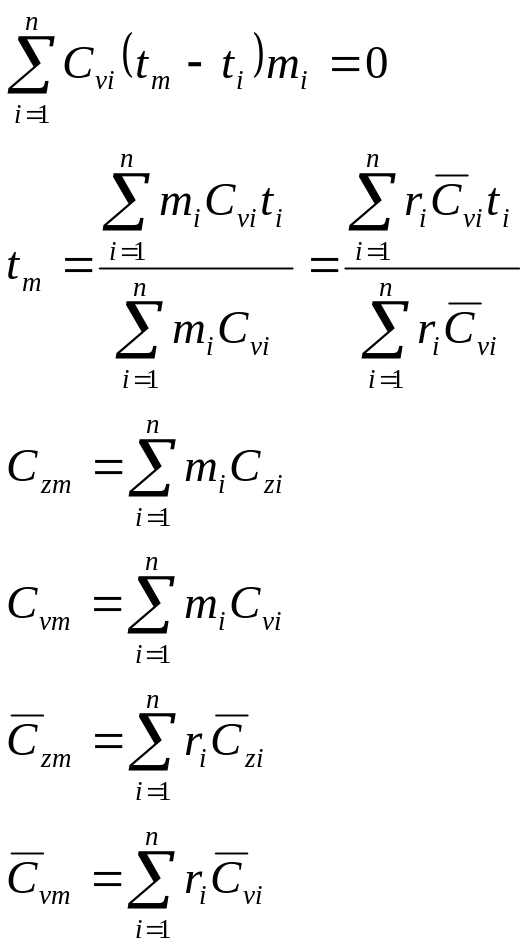 хемы
смешивания газов.
хемы
смешивания газов.
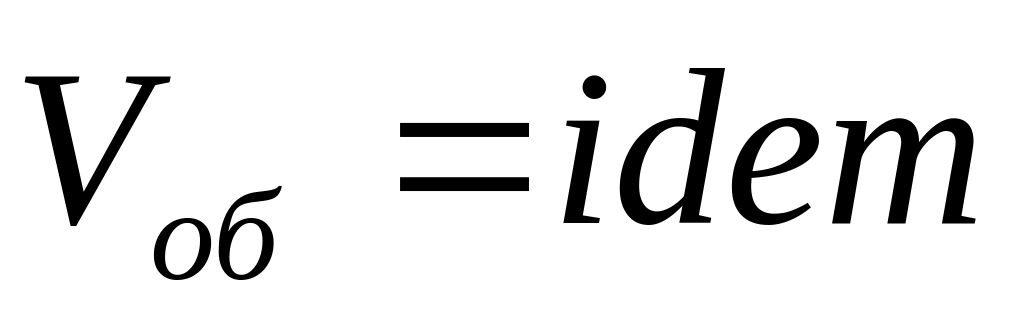 ,
следовательно
,
следовательно
 .
.
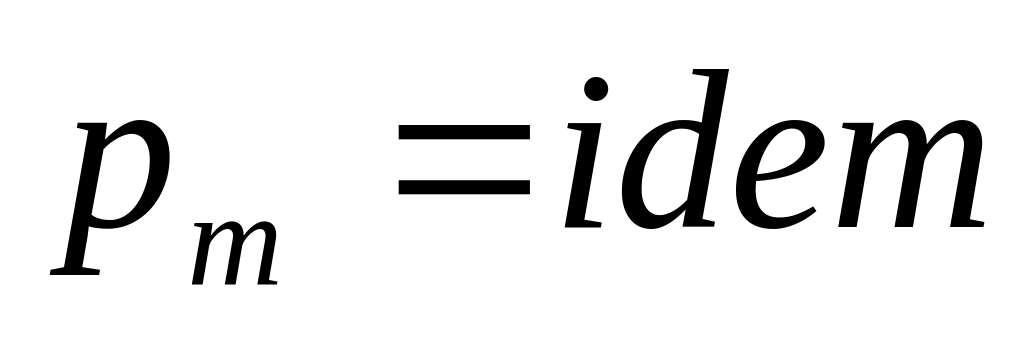 ,
следовательно
,
следовательно
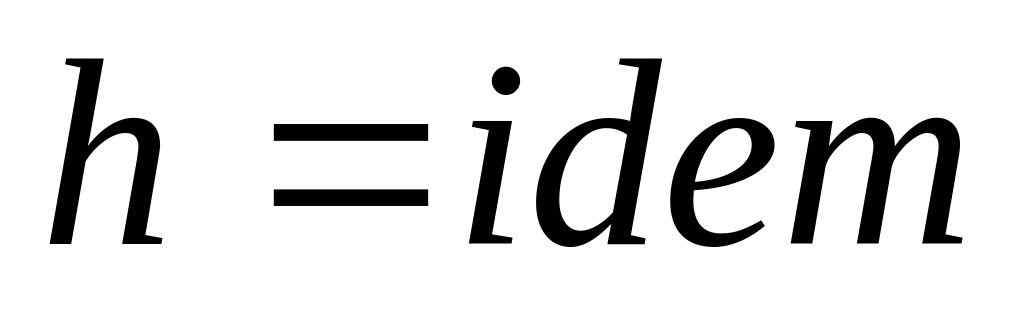 .
.
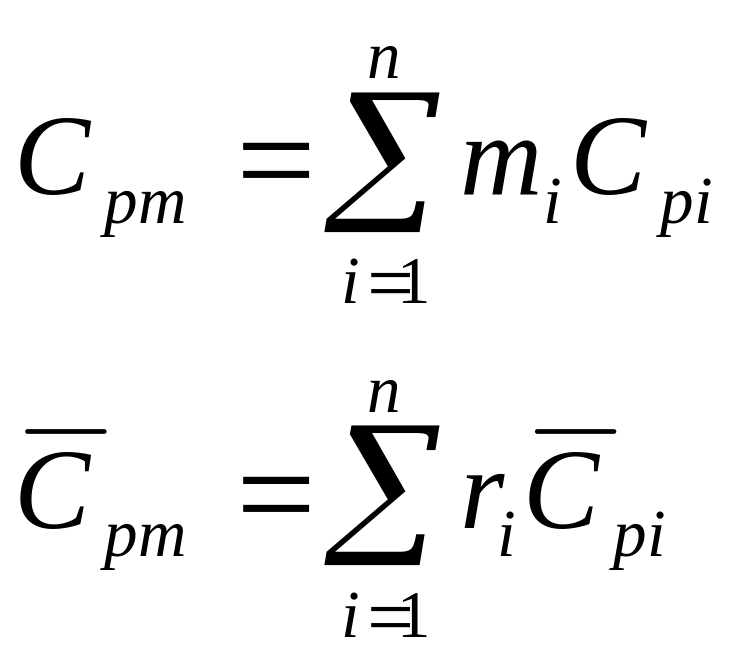
Закон Дальтона: давление смеси равно сумме парциальных давлений компонентов.
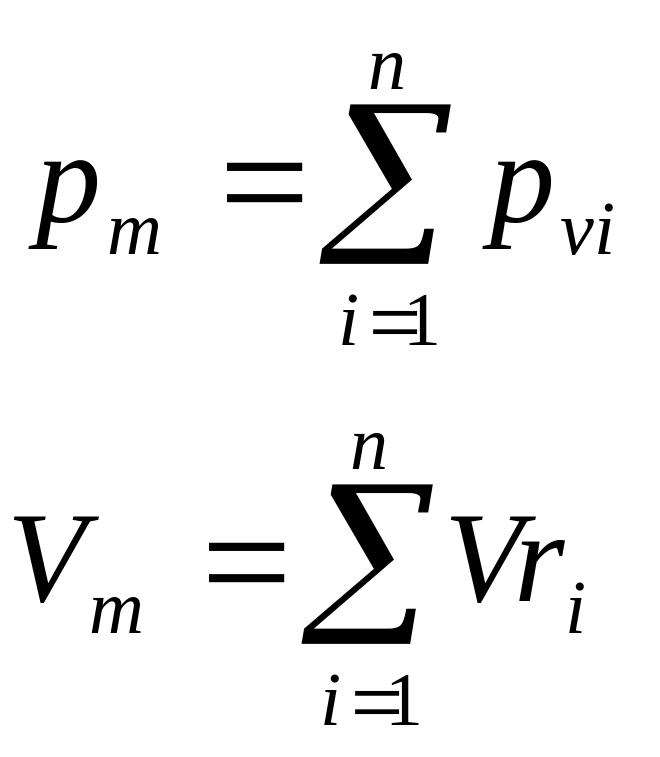

![]()
Вопрос 8. Определение температуры смеси. Теплоемкость смеси
Внутренняя
энергия и энтальпия ИГ -функции только
температуры, исходными соотношениями
для определения средней температуры
смеси идеальных газов
![]() служат следующие соотношения:
служат следующие соотношения:
при
![]()
![]() ;
;
при
![]()
![]() .
.
С учетом соотношений (1.39), (1.40) получаем обобщенное выражение по определению средней температуры смеси идеальных газов для различных схем смешения
![]() ,
(1.41)
,
(1.41)
г![]()
![]() де
де
![]() – массовая и молярная концентрации
i-го
компонента смеси;
– массовая и молярная концентрации
i-го
компонента смеси;
![]() – средние
удельные массовая и молярная теплоемкости
i-го
компонента смеси в процессах
– средние
удельные массовая и молярная теплоемкости
i-го
компонента смеси в процессах
![]() (
(![]() );
);
![]() – средние удельные массовая и молярная
теплоемкости смеси,
– средние удельные массовая и молярная
теплоемкости смеси,
