
- •34. Основные законы геометрической оптики. Принцип Ферма. Полное внутреннее отражение. Призмы.
- •35. Оптические системы. Аберрации оптических систем.
- •36. Интерференция света. Понятие о когерентности.
- •37. Методы наблюдения интерференции в оптике. Интерференция в тонких плёнках. Интерферометры. Применение интерференции.
- •38. Дифракция света. Принцип Гюйгенса-Френеля. Дифракция Френеля.
- •39. Дифракция Фраунгофера на щели. Дифракционная решетка. Дифракция рентгеновских лучей. Формула Вульфа-Брэгга.
- •40. Поляризация света.
- •41. Поглощение и рассеяние света.
- •42. Дисперсия света. Фазовая и групповая скорости. Эффект Вавилова-Черенкова.
- •43. Корпускулярно-волновой дуализм.
- •44. Фотоэлектрический эффект. Фотоны. Уравнение Эйнштейна.
- •45. Тепловое излучение. Законы излучения абсолютно черного тела.
- •46. Волновая функция и ее физический смысл. Уравнение Шредингера.
- •47. Опыт Штерна и Герлаха. Спин и магнитный момент электрона. Квантование энергии, момента импульса и проекции момента импульса.
- •48. Электроны в кристалле. Энергетические зоны.
- •49. Принцип Паули. Периодическая система элементов Менделеева
- •50. Простейшие задачи квантовой механики: квантование энергии частицы в потенциальной яме, линейный гармонический осциллятор. Нулевая энергия.
- •51. Люминесценция. Спонтанное и вынужденное излучение. Лазеры.
- •52. Строение атомов. Опыты Резерфорда. Постулаты Бора. Модель атома водорода по Бору.
- •53. Ядерные реакции деления и синтеза. Ядерная энергетика.
- •54. Радиоактивность. Природа превращений. Закон радиоактивного распада.
- •55. Экспериментальные методы ядерной физики. Ускорители заряженных частиц.
- •Линейный индукционный ускоритель
- •Линейный резонансный ускоритель
- •56. Классификация элементарных частиц. Античастицы.
49. Принцип Паули. Периодическая система элементов Менделеева
В 1869 г. Д.И. Менделеев открыл периодический закон химических и физических свойств элементов в зависимости от атомной массы (рис. 8.2). Выяснилось, что если расположить все химические элементы в порядке возрастания их атомных масс, то обнаруживается сходство физико-химических свойств элементов. Через промежутки, называемые периодами, элементы, расположенные в одном вертикальном ряду – группе элементов, – обнаруживают повторяемость физических и химических свойств. Во времена Менделеева были известны 64 элемента. Расположив их в систему, Менделеев в некоторых случаях должен был отступить от принципа связи периодичности с возрастанием атомной массы (K и Ar). Физический смысл порядкового номера Z элемента периодической системы Менделеева был выяснен в ядерной модели атома Резерфорда. Порядковый номерZэлемента совпадает с числом протонов – положительных элементарных зарядов в ядре. Число их закономерно возрастает на единицу при переходе от предыдущего химического элемента к последующему. Это число совпадает с общим количеством электронов в атоме данного элемента. |
Химические
свойства элементов, их оптические и
некоторые другие физические свойства
объясняются поведением внешних
электронов, называемых валентными
или оптическими.
Периодичность свойств химических
элементов связана с периодичностью в
расположении валентных электронов
атома различных элементов. Объяснение
строения периодической системы элементов,
теоретическое истолкование периодической
системы Менделеева было дано в квантовой
теории Бором в 1922 г. еще до появления
квантовой механики. Последовательная
теория периодической системы основывается
на следующих положениях:
1) общее число электронов в атоме
данного химического элемента равно
порядковому номеру Z
этого элемента; 2) состояние электрона
в атоме определяется набором его четырех
квантовых чисел: n,
l,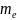 ,
; 3)распределение электронов в атоме по
энергетическим состояниям должно
удовлетворять принципу минимума
потенциальной энергии: с возрастанием
числа электронов каждый следующий
электрон должен занять возможные
энергетические состояния с наименьшей
энергией; 4) заполнение электронами
энергетических уровней в атоме должно
проходить в соответствии с принципом
Паули.
Пример:
Z
= 1 (водород, Н). Единственный электрон
атома водорода находится в состоянии
1s,
характеризуемом квантовыми числами n
= 1, l
= 0, , m
= 0 (ориентация его спина произвольна).
,
; 3)распределение электронов в атоме по
энергетическим состояниям должно
удовлетворять принципу минимума
потенциальной энергии: с возрастанием
числа электронов каждый следующий
электрон должен занять возможные
энергетические состояния с наименьшей
энергией; 4) заполнение электронами
энергетических уровней в атоме должно
проходить в соответствии с принципом
Паули.
Пример:
Z
= 1 (водород, Н). Единственный электрон
атома водорода находится в состоянии
1s,
характеризуемом квантовыми числами n
= 1, l
= 0, , m
= 0 (ориентация его спина произвольна).
Принцип Паули: в атоме не может быть 2 и более электронов которые находились бы в одинаковых состояниях, так как состояние электрона в атоме характеризуется 4 квантовыми числами n,l, , то в любой атомной системе не может быть 2 электронов с одинаковым набором квантовых чисел n,l, , .
Так
как квантовое число
принимает 2 значения
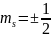 , то иногда говорят что на каждом уровне
находятся 2 электрона с антипараллельными
спиновыми моментами.
, то иногда говорят что на каждом уровне
находятся 2 электрона с антипараллельными
спиновыми моментами.
Согласно
принципу минимума энергии заполнения
электронами слоев атома в невозбужденном
состоянии происходит в порядке замещения
мест соответствует минимуму полной
энергии атома, т.е. электрон занимает
свободное состояние с наименьшей
энергией.Т.к.
принимает 2 значения
,
а число
принимает (2l+1)
значений, то число электронов в подслое
не превышает 2(2l+1).
При заданном квантовом числе m, квантовое
число l принимает значение от 0 до n-1
поэтому максимальное число электронов
в каждом слое можно найти вычислив сумму

Принцип Паули дает объяснение периодической заполняемости электрона атома. Если начать с атома водорода имеющего один электрон то каждый последующий элемент можно получить увеличив заряд ядра последующего элемента на 1 и добавляя еще один электрон который нужно помещать в доступное согласно принципу Паули состояние с наименьшей энергией. Эти электроны постепенно заполняют слой с одним и тем же квантовым числом n. Если заряд водорода увеличить на 1 и добавить электрон, то получиться гелий, оба электрона будут находиться в K оболочке(n=1).но с антипараллельной ориентацией спинов.
