
- •1. Принцип энергии. Первое начало термодинамики для движущегося газа
- •2. Принцип энтропии. Показать знак изменения энтропии системы при теплообмене
- •3. Термодинамические функции состояния и процесса
- •4. Термодинамическое определение температуры через количество возбужденных и невозбужденных атомов
- •5. Формула Больцмана для энтропии системы. Определить энтропию системы, состоящую из 1000 атомов, 2 из которых находятся в возбужденном состоянии
- •6. Требования к температурному состоянию системы «газотурбинный двигатель»
- •7. Источники тепла в двигателе. Максимально и минимально возможные уровни температур
- •9. Диаграмма теплового баланса при сгорании (окислении) топлива. Высшая и низшая теплотворные способности топлива
- •10. Классификация нефти по групповому составу
- •11. Физические механизмы переноса тепла
- •12. Понятие пограничного слоя. Критерий принадлежности пограничному слою. Толщина пограничного слоя
- •13. Толщина вытеснения, потери импульса и энергии
- •14. Вывод уравнения Кармана и его анализ
- •16. Уравнение движения газа для турбулентного течения
- •19. Понятие коэффициента теплоотдачи и его связь с коэффициентом теплопроводности. Смысл введения коэффициента теплоотдачи
- •20. Связь коэффициента теплоотдачи с числом Рейнольдса
- •22. Факторы, влияющие на процессы теплоотдачи при обтекании лопаток турбины в реальных условиях
- •23. Турбулентность и ее измерение. Спектр турбулентности. Волновое число
- •24. Понятие эффективной турбулентности. Энергетический и диссипативный диапазоны волновых чисел
- •25. Эффективность конвективного охлаждения. Анализ его выражения. Критерий оптимальности эффективного охлаждения
- •26. Пленочное охлаждение. Эффективность пленочного охлаждения. Основной фактор влияния на эффективность
- •27. Зависимость Кутателадзе-Леонтьева
- •28. Соотношения Кришнамурти и Абу-Ганэма влияния турбулентности на коэффициент теплоотдачи
- •30. Механизм влияния нестационарности на эффективность пленочного охлаждения
- •31. Трехмерные эффекты в граничных условиях на поверхности лопаток турбин
- •32. Изменение коэффициента теплоотдачи во внутреннем петлевом канале охлаждающего воздуха (со стороны спинки и корыта) при вращении и его отсутствии. Число Россби
- •33. Параметр оребрения. Влияние оребрения на эффективность охлаждения
- •34. Смысл лобового натекания. Критериальное выражение для коэффициента теплоотдачи при лобовом натекании
- •35. Понятие термоциклического нагружения. Фазовые траектории термического нагружения лопаток и дисков
1. Принцип энергии. Первое начало термодинамики для движущегося газа
Энергия - это способность системы совершать работу.
Принцип энергии: энергия системы сохраняется, т.е. изменение состояния системы происходит строго на величину подвода(отвода энергии)
Закон сохранения энергии в форме первого начала термодинамики:
Подведенное
к системе тепло идет на увеличение
внутренней энергии и совершение внешней
работы, или
 .
Внешняя работа совершается за счет
расширения (перемещения) рабочего тела
против внешних сил и в движущемся газе
может расходоваться на изменение
кинетической (WdW) и потенциальной (gdZ)
энергий, на «проталкивание» движущегося
объёма газа (dpv), на выполнение технической
работы (с помощью технических
устройств-турбины, компрессора и т.п.)
dL, на преодоление сил трения dLf.
.
Внешняя работа совершается за счет
расширения (перемещения) рабочего тела
против внешних сил и в движущемся газе
может расходоваться на изменение
кинетической (WdW) и потенциальной (gdZ)
энергий, на «проталкивание» движущегося
объёма газа (dpv), на выполнение технической
работы (с помощью технических
устройств-турбины, компрессора и т.п.)
dL, на преодоление сил трения dLf.
Теплота-это способ передачи энергии нагреванием. Работа- это способ передачи энергии без теплообмена.
Температура-это мера теплового состояния системы. Одинаковые температуры характеризуют одинаковые тепловые состояния систем и, соответственно, отсутствие потока теплоты между системами (тепловое равновесие).
2. Принцип энтропии. Показать знак изменения энтропии системы при теплообмене
Принцип энтропии: энтропия системы увеличивается в процессе теплообмена, или, эквивалентно, теплообмен всегда идет в одном направлении-от горячего источника к холодному (второе начало термодинамики). Т.е. происходит рассеяние внутренней энергии в пространстве.
Изменение
энтропии системы:
 .
.
Пример 1:
В процессе теплообмена (
 )между
телами, имеющими различные температуры
Т1
и Т2,
причем Т1>
Т2,
энтропия системы увеличивается.
)между
телами, имеющими различные температуры
Т1
и Т2,
причем Т1>
Т2,
энтропия системы увеличивается.
В самом деле, в
теле с температурой Т1
изменение энтропии
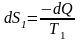 ,
,
а в теле с
температурой Т2
соответственно
 .
Суммарное изменение энтропии равно
.
Суммарное изменение энтропии равно
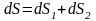 .
Так как Т1
больше Т2,
то
.
Так как Т1
больше Т2,
то
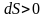 .
.
3. Термодинамические функции состояния и процесса
Термодинамические процессы описываются функциями состояний (т.е. независимо от вида процесса)- внутренняя энергия, энтальпия, и функциями процессов-работа, тепло, теплоемкость.
Фундаментальными понятиями термодинамики систем являются состояние и переход. Соответственно, состояние системы характеризуется тремя видами: равновесное состояние, переход в другое состояние в результате внешнего воздействия (подвод тепла или работы к системе) и самопроизвольный переход из одного (неравновесного) состояния в другое (равновесное) состояние. Соответственно, количественной мерой теплового равновесия является температура(мера теплового состояния системы), перехода в другое состояние—энергия(способность системы совершать работу против внешних сил), а направления самопроизвольного перехода системы при неравновесном состоянии—энтропия.
4. Термодинамическое определение температуры через количество возбужденных и невозбужденных атомов
Поскольку
температура(мера теплового состояния
системы) характеризует хаотическое
движение атомов, то естественно её
определить через соотношение числа
возбужденных атомов к числу невозбужденных
(при допущении квантовой неразличимости
атомов и двух энергетических уровней)
. Или
 , где А-константа, зависящая от энергии
возбуждения атома, N1
, N2
–соответственно
число невозбужденных и число возбужденных
атомов.
, где А-константа, зависящая от энергии
возбуждения атома, N1
, N2
–соответственно
число невозбужденных и число возбужденных
атомов.
Примечание: система может иметь высокий уровень энергии (большая масса), но низкую температуру, т.е. низкое соотношение числа возбужденных и невозбужденных атомов. Типичный пример—океан.
