
Контрольная работа
4. Решение.
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Число электронов того или иного элемента равно его порядковому номеру в таблице Менделеева.
Марганец (Mn) элемент побочной подгруппы VII группы 4 периода, относится к электронному семейству марганца.
25Mn 1s2 2s2 2р63s23р63d54s2
Селен (Se) элемент главной подгруппы VI группы 4 периода, относится к электронному семейству халькогенов.
34Se 1s2 2s2 2р63s23р4
24. Решение.
Тепловой эффект данной реакции равен теплоте образование NO.
N2 + O2 2NO
Исходя из следующих термохимических уравнений вычислим теплоту образования NO:
4NH3+5O2(г)=4NO(г)+6H2 O(ж); ΔH=-1168,80 кДж 4NH3+3O2(г)=2N2(г)+6H 2O(ж); ΔH=+1530,28 кДж
ΔНобр(NO) = (ΔH2 – ΔH1)/4
ΔНобр(NO) = (1530,28-1168,80)/4=90,37 кДж.
44. Решение
Реакция горения ацетилена идет по уравнению:
С2Н2(г) + 5/2 О2 (г) = 2СО2(г) + Н2О(ж)
Стандартные абсолютные энтропии продуктов реакции:
Ацетилена С2Н2(г): S1 = 200,82 Дж/(моль·К);
Кислорода О2(г): S2 = 205,03 Дж/(моль·К);
Углекислого газа СО2(г): S3 = 213,65 Дж/(моль·К);
Воды Н2О(ж): S4 = 69,94 Дж/(моль·К).
Изменение энтропии в результате реакции определяется по формуле:
ΔSреак. = ΣSпрод. – ΣSисх.
В нашем случае
ΔSреак. = S4 + 2S3 – 5/2S2 – S1
ΔSреак. = 69,94 + 2 ∙ 213,65 – 5/2 · 205,03 – 200,82 = - 216,15 Дж/(моль·К).
Стандартные энергии Гиббса образования веществ:
Ацетилена С2Н2(г): ΔG1 = 209,20 кДж/моль;
Углекислого газа СО2(г): ΔG2 = - 394,38 кДж/моль;
Воды Н2О(ж): ΔG3 = - 237,19 кДж/моль;
Изменение энергии Гиббса в результате реакции определяется по формуле:
ΔGреак. = ΣΔGпрод – ΣΔGисх
В нашем случае
ΔGреак. = ΔG3 + 2 ΔG2 – ΔG1
ΔGреак. = - 237,19 – 2 · 394,38 – 209,20 = - 1235,15 кДж/моль.
В результате химической реакции энтропия может как увеличиваться, так и уменьшаться, так возможность самопроизвольного протекания процесса определяется не изменением энтропии, а изменением энергии Гиббса.
64. Решение
Приближенно зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа, согласно которому при увеличении температуры на 10С скорость большинства гомогенных реакций увеличивается в 2-4 раза:
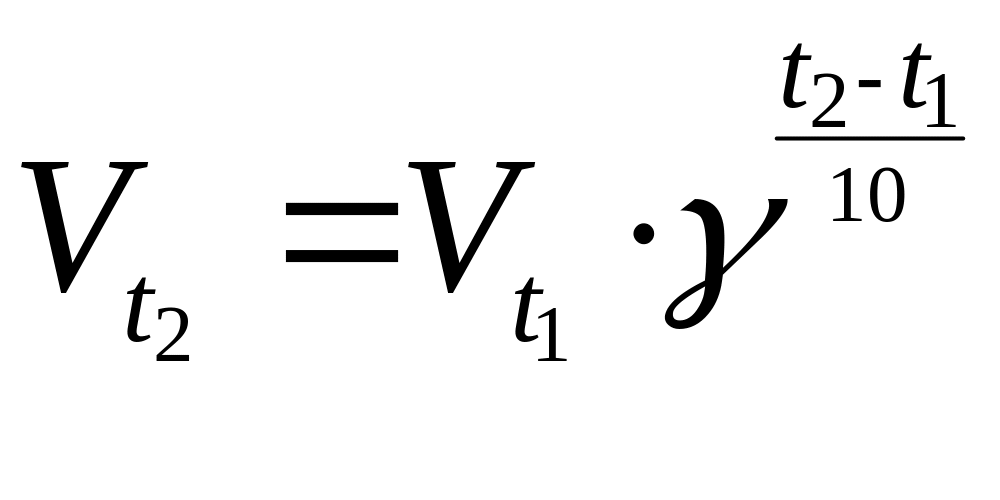
В данном примере температура понизилась на 40 С (t2-t1=120-80=40C)
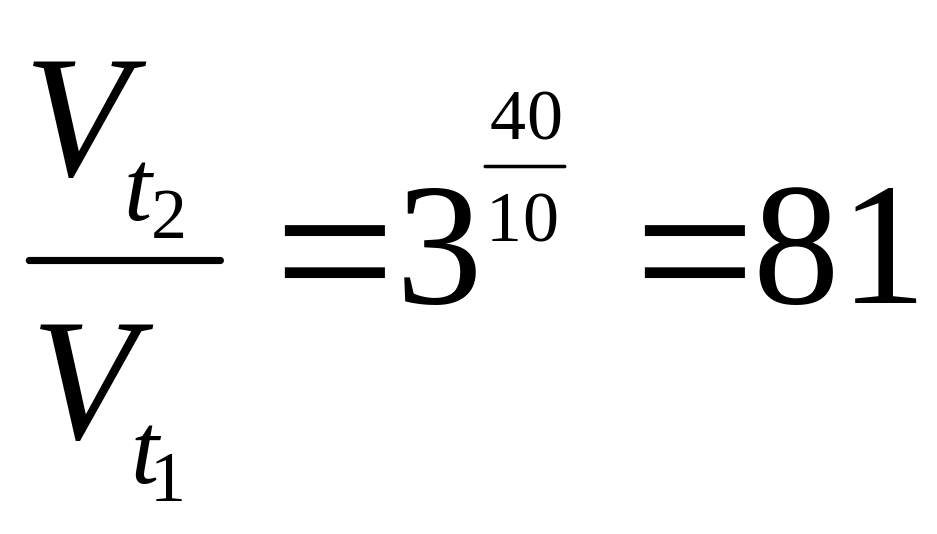
Следовательно, скорость реакции (V2) при температуре 120°С уменьшилась по сравнению со скоростью реакции (V1) при температуре 80C в 81 раз.
84. Решение
Дано: m(Zn) = 80 г V(HCl) = 200 мл (HCl) = 20% (HCl) = 1,1 г/мл |
Решение: Запишем уравнение реакции: Zn + 2HCl = ZnCl2 + H2 Рассчитаем количества вещества соляной кислоты: m (HCl) = V m (HCl) = 0,21,1200 = 44 г |
Найти: m(Zn) V(H2) |
(HCl) = m/M
(HCl) = 44/36,5 = 1,205 моль, отсюда
(Zn) = 0,6025 моль – количества вещества цинка по уравнению реакции
(Zn) = m/M
(Zn) = 80/65 = 1,231 моль
Поскольку цинк в избытке объем водорода найдем по кислоте:
(Н2) = 1,205 / 2 = 0,6025 моль
V (H2) = Vm
V (H2) = 0,602522,4 = 13,496 л.
