
Содержание
Работа 1
Распределение вещества между двумя несмешивающимися растворителями
Работа 2
Изменение давления насыщенного пара
Работа 3
Определение парциальных молярных объемов
Работа 4
Изменение равновесия жидкость – пар в бинарных растворах
Работа 5
Определение адсорбции компонента из раствора
Работа 6
Изучение растворимости в трехкомпонентной системе
Работа 7
Определение теплоты растворения
Работа 8
Определение теплоты образования твердого раствора из двух твердых компонентов
Основные требования при выполнении работ и их оформлении
Список литературы
Работа 1
РАСПРЕДЕЛЕНИЕ ВЕЩЕСТВА МЕЖДУ ДВУМЯ НЕСМЕШИВАЮЩИМИСЯ РАСТВОРИТЕЛЯМИ
Теоретическое введение
Если к системе из двух несмешивающихся жидкостей добавить третье вещество, растворимое в той и другой жидкости, то оно распределяется между жидкостями в определенном, постоянном при данной температуре соотношении. Закон, характеризующий это распределение, можно установить таким образом.
Предположим, что растворенное вещество в обоих растворителях находится в одинаковом состоянии, например, в виде мономерных молекул. Запишем условие равновесия для такой системы:
Т(1)=Т(2)
Р(1)=Р(2)
µ(1)=µ(2) (1)
где µ(1) и µ(2) - химические потенциалы растворенного вещества в фазе 1 и фазе 2.
Для реальных растворов зависимость химических потенциалов от состава передается уравнениями
µ(1)=µ0(1)+RTlnα(1) (2)
µ(1)=µ0(2)+RTlnα(2) (3)
где µ0(1) и µ0(2) - стандартные химические потенциалы в фазе 1 и фазе 2
α(1) и α(2)- активность вещества в фазе 1 и фазе 2.
Из уравнений (1)-(3) следует:
µ0(1)+ RTlnα(1)= µ0(2)+RTlnα(2)
 (4)
(4)
где К – коэффициент распределения
Значения стандартных химических потенциалов зависят от температуры, давления и природы растворителя и по определению не зависят от активности. Следовательно, значение коэффициента распределения не зависит от активности растворенного вещества, но, в общем случае, зависит от концентрации.
Для идеальных и бесконечно разбавленных растворов активность равна концентрации, и (4) преобразуется к виду
 (5)
(5)
где С(1) и С(2) - концентрация вещества в фазе 1 и фазе 2.
Цель работы: определить коэффициент распределения уксусной кислоты (НАс) между водой и изоамиловым спиртом методом повторной экстракции. Уксусную кислоту, растворенную в органической фазе (изоамиловом спирте), последовательно экстрагируют несколькими одинаковыми порциями второй фазы (водной) и в этих отдельных экстрактах определяют количественно содержание уксусной кислоты.
Введем обозначения:
Vв – объем отдельных порций водной фазы, л;
Vорг – объем органической фазы, л;
C0 (орг) – начальная концентрация НА в изоамиловом спирте, моль/л;
C i (в) – концентрация Нас в водной фазе после i-го экстрагирования.
Запишем выражения для константы распределения после первого экстрагирования
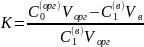
и после второго экстрагирования

Исключив
неизвестную величину
 ,
получим
,
получим

Для (i+1)-го экстрагирования
 (6)
(6)
Точность
определения константы распределения
зависит от разности ( ).
Чем меньше разность, тем больше ошибка.
Ошибка будет минимальной, если эксперимент
спланирован так , что выполняется условие
(
).
Чем меньше разность, тем больше ошибка.
Ошибка будет минимальной, если эксперимент
спланирован так , что выполняется условие
( ).
При К≈1 это условие соблюдается, если
).
При К≈1 это условие соблюдается, если
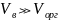 .
Значит, можно провести максимум два
последовательных экстрагирования.
Поэтому для изучаемой системы наиболее
оптимальным является условие
.
Значит, можно провести максимум два
последовательных экстрагирования.
Поэтому для изучаемой системы наиболее
оптимальным является условие
 ..
..
Экспериментальная часть
Для работы необходимы: делительная воронка на 100 мл, мерный цилиндр на 50 мл, четыре колбочки по 100 мл (рис. 1), колба на 250-300 мл, бюретка на 50 мл, пипетка на 20 мл, 0,4-0,5 моль/л раствор уксусной кислоты в изоамиловом спирте, 0,1н раствор щелочи, фенолфталеин.
Перед проведением опытов необходимо при помощи воды проверить на герметичность кран и стеклянную пробку делительной ворон ки. Изоамиловый спирт в количестве 40 мл с растворенной уксусной кислотой вливают в делительную воронку, добавляют 40 мл воды, насыщенной изоамиловым спиртом и проводят экстракцию.
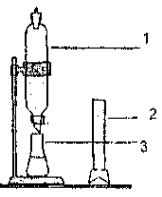 рис.1
Прибор для измерения коэффициента
распределения: 1 – делительная воронка,
2 – мерный цилиндр, 3 – колба.
рис.1
Прибор для измерения коэффициента
распределения: 1 – делительная воронка,
2 – мерный цилиндр, 3 – колба.
Воду, насыщенную изоамиловым спиртом, получают, смешивая воду и изоамиловый спирт без уксусной кислоты и проводя все нижеописанные операции 1-3. Экстрагирование проводят 4 5 раз. Водный слой после каждого экстрагирования объединяют с предыдущими порциями, сливая его в колбу на 250-300 мл.
Последовательность операций при выполнении экстракции
1 .Закрыв делительную воронку стеклянной пришлифованной пробкой, правой рукой берутся за горлышко с пробкой, а левой - за кран так, чтобы суженная часть конуса помещалась в ладони, а пальцем можно было бы свободно поворачивать кран. Если держать в ладони сам корпус делительной воронки, то тепло руки повысит давление паров растворителя в воронке, в результате чего пробка и кран могут выскочить.
2.Делительную воронку поворачивают сливной трубкой кверху и осторожно приоткрывают кран. После сброса избыточного давления дают возможность жидкости, которая увлекается струей паров в сливную трубку, стечь обратно в воронку. Закрыв кран, воронку несколько раз встряхивают и снова открывают кран. Интенсивное встряхивание и выравнивание давления в делительной воронке с атмосферным давлением повторяют несколько раз для обеспечения достижения равновесия фаз.
3.Укрепив делительную воронку на штативе, ожидают разделения фаз. Открывают пробку и сливают нижнюю (водную) фазу в колбочку. Верхнюю фазу оставляют в воронке.
Затем в делительную воронку добавляют тот же (40 мл) объем воды, насыщенной изоамиловым спиртом, снова повторяют описанные выше операции 1-3. Экстрагирование проводят 4 - 5 раз. Из слитой каждый раз водной фазы берут пробы по 20 мл и титруют 0,1н раствором щелочи в присутствии фенолфталеина.
Результаты титрования записывают в табл. 1. По формуле (6) вычисляют К и делают выводы: остается ли К постоянным, независимым от концентрации уксусной кислоты; если нет, то почему. Сравнивают полученное значение константы распределения с литературными значениями. Обязательно указывают библиографические данные литературного источника.
Работа 2
ИЗМЕРЕНИЕ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА
Теоретическое введение
Насыщенным называется пар, находящийся в равновесии с жидкостью. Давление насыщенного пара зависит от природы вещества и температуры. Если жидкость находится в равновесии с паром, то
Т(пар)=Т(ж) (7)
Р(пар)=Р(ж) (8)
G(пар)(Р, Т)= G(пар)(Р, Т) (9)
Где
 и
- мольный потенциал Гиббса вещества в
паре и в жидкой фазе.
и
- мольный потенциал Гиббса вещества в
паре и в жидкой фазе.
Выведем дифференциальное уравнение кривой сосуществования двух фаз. При движении вдоль кривой сосуществования в каждой ее должны соблюдаться условия (7)-(9). Следовательно,
dT(пар)=dT(ж)=dT,
dP(пар)=dP(ж)=dP,
dG(пар)(P, T)=dG(ж)(P, T)
Используя уравнение dG=VdP-SdT, получим
(Vп
– Vж)dP=(Sп
– Sж)dT=ΔSипсdT
или
 ,
,
где Vп и Vж – молярные объемы жидкой и газообразной фаз;
ΔSипс – изменение энтропии при образовании 1 моля пара;
ф.п. – фазовый переход.
В свою очередь, ΔSипс=ΔНисп/Тф.п. Поэтому
 ,
(10)
,
(10)
ΔНисп - теплота образования I моль пара при испарении или мольная теплота испарения. Уравнение (10) является строгим и показывает, что производная dP/dT всегда положительна, т.е. с ростом температуры давление насыщенного пара возрастает. Рассмотрим следующие допущения.
1 Используя уравнение Ван-дер-Вальса можно показать, что отклонение давления насыщенного пара от идеального при Р<1 атм.не превышает 1% и не зависит от сложности молекул, ни от Ткип. Иными словами, насыщенный пар при Р<1атм подчиняется законам идеальных газов. Тогда Vп=RT/Р.
2 Vп/Vж=МР/(dRT), здесь d – плотность жидкости; М – молекулярная масса. Из этого выражения следует, что ошибка, связанная с пренебрежением объемом жидкой фазы, будет наибольшей для легко летучих веществ с большим молекулярным весом. В подавляющем большинстве случаев Vж<0,05Vп. Например, для аргона Vж=0,04Vп.
Следовательно, Vж можно принебречь.
С учетом этих допущений уравнение (10) может быть приведено к виду
 (11)
(11)
В области давлений не выше 1-2 атм и в интервале температур 100-1500С зависимостью ΔНисп от температуры можно принебречь. Интегрирую уравнение (11), получим

Физический смысл постоянной интегрирования становится ясным при условии Т= Ткип и Р=1 амт:

Обозначив В= -ΔНисп/(2,3R) и А= ΔSипс/(2,3R), получим
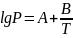 (12)
(12)
Уравнение (12) широко используется для описания зависимости давления насыщенного пара от температуры, для определения теплоты испарения жидкости, энтропии образования.
