
- •Практическое занятие № 15. Задание к занятию № 15.
- •Входной контроль знаний:
- •Основные вопросы темы:
- •Лабораторно-практические работы.
- •Выходной контроль.
- •Литература:
- •2. Основные вопросы темы.
- •Макроэргические соединения. Атф – универсальный аккумулятор и источник энергии в организме. Цикл атф-адф. Энергетический заряд клетки.
- •Этапы обмена веществ. Биологическое окисление (тканевое дыхание). Особенности биологического окисления.
- •Первичные акцепторы протонов водорода и электронов.
- •Организация дыхательной цепи. Переносчики в дыхательной цепи (цпэ).
- •Цитохромы.
- •Окислительное фосфорилирование адф. Механизм сопряжения окисления и фосфорилирования. Коэффициент окислительного фосфорилирования (р/о).
- •V комплекс – атф-синтаза.
- •Дыхательный контроль. Разобщение дыхания (окисления) и фосфорилирования (свободное окисление).
- •Образование токсичных форм кислорода в цпэ и обезвреживание перекиси водорода ферментом пероксидазой.
- •Лабораторно-практические работы.
- •3.2. Методика определения пероксидазы в картофеле.
- •Практическое занятие № 16. Задание к занятию № 16.
- •Основные вопросы темы.
- •Терморегуляторная функция цпэ.
- •Короткие пути окисления.
- •Общий путь катаболизма – цикл трикарбоновых кислот (цтк).
- •Функции цтк.
- •Энергетический баланс цтк.
- •Гипоэнергетические состояния, причины.
- •Микросомальное окисление, биологическая роль.
- •Обезвреживание перекиси водорода ферментом каталазой.
- •Лабораторно-практические работы.
- •Определение каталазной активности в интактных эритроцитах по методу Крайнева.
- •Практическое занятие № 17 (контрольное). Задание к занятию № 17.
- •Основные вопросы темы.
- •Лабораторно-практические работы.
Гипоэнергетические состояния, причины.
Для постоянного синтеза АТФ клетками необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряженных с синтезом АТФ.
Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки.
Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические».
Причины «гипоэнергетических состояний»:
Голодание (недостаток субстратов дыхания);
Гиповитаминозы В1, В2, В3, РР – эти витамины входят в состав ферментов, участвующих в транспорте электронов на кислород.
Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях легких и нарушении легочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей; при наследственных и приобретенных нарушениях структуры гемоглобина (анемии) и др.
Микросомальное окисление, биологическая роль.
Протекает в микросомах эндоплазматического ретикулума.
10% молекулярного кислорода не является акцептором протонов Н+ , а непосредственно включается в молекулу субстрата;
В процессе микросомального окисления АТФ не синтезируется.
Функции.
Детоксикационная (обезвреживающая) функция. В реакциях микросомального окисления субстраты гидроксилируются, повышается их растворимость, что способствует их выведению или снижению их токсичности (вывод лекарственных веществ из организма, избытка холестерина и т.д.);
Пластическая функция – синтез различных соединений:
- из холестерина образуются желчные кислоты, стероидные гормоны (гормоны коры надпочечников, половые гормоны);
-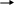 из пролина оксипролин;
из пролина оксипролин;
- из лизина оксилизин;
- из фенилаланина тирозин и др.
В реакциях микросомального окисления участвуют ферменты- гидроксилазы (оксигеназы), которые делятся на монооксигеназы, катализирующие включение одного атома кислорода в молекулу субстрата и диоксигеназы- включение двух атомов кислорода в молекулу субстрата.
Обезвреживание перекиси водорода ферментом каталазой.
В организме существуют защитные механизмы:
- гемсодержащие ферменты: каталаза, которая расщепляет Н2О2:
каталаза
2 Н2О2
2Н2О
+ 2О2
Н2О2
2Н2О
+ 2О2
- супероксиддисмутаза (СД), глутатионпероксидаза, обезвреживающие О2ˉ:
СД
2 О2-
+ 2Н+
2Н2О2
+ О2
О2-
+ 2Н+
2Н2О2
+ О2
каталаза
2 Н2О2 2Н2О + 2О2
- антиоксиданты, обезвреживающие свободные радикалы – витамины Е, А, С; глутатион, цистеин, биофлавоноиды, Q10 , мочевая кислота, янтарная кислота, селенит натрия и др.
Лабораторно-практические работы.
Определение каталазной активности в интактных эритроцитах по методу Крайнева.
Об активности каталазы можно судить либо по количеству перекиси водорода, разложившейся под влиянием этого фермента, либо по количеству выделившегося при этом кислорода. По методу Крайнева активность каталазы выражают в микромолях перекиси водорода, разложенной 1 мл крови в течение минуты. Каталаза крови содержится почти исключительно в эритроцитах. Активность этого фермента снижается при некоторых заболеваниях, например анемии, туберкулезе, раке и др.
Ход работы:
Приготовить суспензию эритроцитов: отмерить в пробирку 5 мл 0,85% раствора хлористого натрия и добавляют туда 0,1 мл крови, тщательно перемешивая.
Отмерить в две пробирки по 5 мл 10% раствора серной кислоты.
Отмерить в два тигля по 2 мл 0,5 М раствора перекиси водорода.
Отмерить в два стакана по 6 мл 0,85% раствора хлористого натрия и по 2 мл суспензии эритроцитов.
С помощью пинцета поместить на дно каждого стакана тигель с перекисью водорода.
В первый стакан (контроль) влить из пробирки 5 мл 10% раствора серной кислоты и перемешать содержимое (инактивация каталазы).
Второй стакан с тиглем (опыт) вращают до перемешивания содержимого, каталаза эритроцитов начинает разлагать перекись водорода. Перемешивание продолжают в течение 30 секунд, после чего вливают в него 5 мл 10% раствора серной кислоты из пробирки. Реакция приостанавливается. Избыток перекиси водорода в обоих стаканах (опыт и контроль) титруют 0,1N раствором перманганата калия до появления розовой окраски, не исчезающей в течение 30 секунд.
Вычисление производят по формуле:
 (А
- В)
1,7
2
(А
- В)
1,7
2
0,04 34
1 мл 0,1N раствора KMnO4 эквивалентен 1,7 мг перекиси водорода
0,04 – количество крови в стакане
А – количество миллилитров 0,1N раствора KMnO4 , пошедшего на титрование контрольного стакана,
В – количество миллилитров 0,1N раствора KMnO4 , пошедшего на титрование опытного стакана,
В норме активность каталазы равна 12-20 ммоль/мл/мин.
