
- •ОбЩая химИя
- •Введение
- •Правила работы в лаборатории
- •Определение эквивалентной массы
- •Общие сведения
- •Контрольные вопросы
- •Лабораторная работа № 1. Определение эквивалентной массы металла Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 2. Определение эквивалента карбоната натрия
- •Оборудование и реактивы
- •Выполнение работы.
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 3. Исследование скорости химических реакций и химического равновесия
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка экспериментальных данных
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 4. Приготовление раствора и определение его концентрации
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 6. Исследование гидролиза солей
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 7. Приготовление буферного раствора
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •I. Выбрать реактивы для приготовления буферного раствора.
- •II. Рассчитать объемы реактивов для приготовления буферного раствора.
- •III. Приготовить буферный раствор и определить его рН
- •IV. Определить буферную емкость
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 8. Исследование растворимости солей
- •Общие сведения
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Контрольные вопросы
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 12. Определение теплоты растворения соли
- •Общие сведения
- •Оборудование и реактивы
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Содержание
Контрольные вопросы
1. Какие соединения называются координационными или комплексными?
2. Каковы основные структурные единицы комплексного соединения?
3. Каков тип связи во внутренней сфере комплексного соединения?
4. Что такое координационное число?
5. Как оценить дентатность лиганда?
6. Как диссоциируют комплексные соединения?
7. Как протекает диссоциация координационной части комплексного соединения?
Оборудование и реактивы
В штативе: хлорид калия, хлорид натрия, сульфат никеля, гидроксид аммония, сульфат меди, хлорид бария, хлорид кадмия, гидроксид натрия (калия), иодид калия, нитрат висмута (III), сульфат кобальта, сульфат цинка, хлорид железа (III), роданид аммония (калия), оксалат аммония, перманганат калия. В вытяжном шкафу: гидроксид аммония – концентрированный раствор, азотная кислота 2 н. раствор, гидроксид натрия (калия) – 6 н. раствор, соляная кислота – раствор концентрацией 15 %, соляная кислота – 2 н. раствор, серная кислота – 2 н. раствор. Получать в лаборантской: пробирки – 5 шт.; нитрат серебра, нитрат ртути (II), гесацианоферрат (II) калия, гесацианоферрат (III) калия, сульфат железа (II), гесанитрокобальтат (III) натрия, хлорид хрома (III) – растворы концентрацией 5 %; бромид калия – насыщенный раствор; бензол; олово металлическое; цинк металлический.
Выполнение работы
Образование комплексных соединений
Опыт 1. Образование и разрушение амминокомплекса серебра. Налить в пробирку 3−4 капли раствора нитрата серебра, добавить столько же раствора хлорида натрия (или хлорида калия). Отметить выпадение осадка хлорида серебра. Затем в вытяжном шкафу добавить в пробирку 3−5 капель концентрированного раствора аммиака и несколько раз встряхнуть. Осадок должен раствориться вследствие образования амминокомплекса серебра. Подкислить раствор аммиаката серебра азотной кислотой. Должен образоваться осадок хлорида серебра.
Опыт 2. Получение амминокомплекса никеля. Налить в пробирку 3−4 капли раствора сульфата никеля. Добавить каплю разбавленного раствора аммиака, который находится в штативе с реактивами. В пробирке образуется студенистый осадок сульфата гидроксоникеля. Добавить в вытяжном шкафу 4−10 капель концентрированного раствора аммиака до полного растворения осадка. Обратите внимание на окраску раствора, обусловленную образованием в растворе катиона гексаамминоникеля (2+). К полученному раствору добавить 1 мл насыщенного раствора бромида натрия (или бромида калия). Должен выпасть осадок бромида гексаамминоникеля. Запишите уравнения всех реакций в молекулярной и ионной формах.
Опыт 3. Образование и реакции амминокомплекса меди.
Поместить в две пробирки по 10 капель раствора сульфата меди. В первую пробирку добавить 2 капли раствора соли бария. На присутствие какого иона указывает выпавший осадок? Во вторую пробирку внести кусочек гранулированного олова и наблюдать выделение на его поверхности красноватого налета меди.
Получить комплексное соединение меди, для чего поместить в пробирку несколько капель раствора сульфата меди и по каплям добавлять концентрированный раствор аммиака. Наблюдать растворение выпавшего вначале осадка основного сульфата меди и изменение цвета раствора при образовании комплексного сульфата тетраамминомеди (II).
Полученный раствор разделить в две пробирки и провести те же два опыта, которые были проделаны с раствором медного купороса. Выпадает ли осадок при добавлении хлорида бария? Выделяется ли медь на грануле олова? Написать уравнения всех проведенных реакций. Есть ли различие в поведении сульфата меди и комплексной соли по отношению к каждому добавленному реактиву?
Учитывая, что данные по мольной электропроводности раствора комплексного соединения указывают на диссоциацию его на 2 иона, написать его формулу и уравнение электролитической диссоциации.
Опыт 4. Получение комплексного основания кадмия. Получить в пробирке осадок гидроксида кадмия, добавляя к раствору его соли равный объем раствора едкого натра. На полученный гидроксид подействовать концентрированным раствором аммиака до полного растворения осадка.
Написать уравнения реакций получения гидроксида тетраамминкадмия и его электролитической диссоциации. Какое основание является более сильным электролитом: гидроксид кадмия или его комплексное основание? Ответ обосновать.
Опыт 5. Получение тетраиодовисмутата калия. В пробирку к 3–4 каплям раствора нитрата висмута прибавлять по каплям раствор иодида калия до выпадения темно-бурого осадка иодида висмута. Растворить этот осадок в избытке раствора иодида калия. Каков цвет полученного раствора? Может ли эта окраска обусловливаться присутствием ионов K+, I–, Bi3+? Какой из этих ионов может быть комплексообразователем? С какими лигандами он мог образовать в данном растворе сложный ион? Ответ мотивировать.
Опыт 6. Получение комплексного йодида ртути. Налить в пробирку 3−4 капли раствора нитрата ртути (II) и добавить 1−2 капли раствора иодида калия. Отметить цвет образующегося осадка дииодида ртути. В пробирку по каплям добавить избыток раствора иодида калия до полного растворения полученного осадка, которое обусловлено образованием в растворе комплексных анионов тетрайодомеркурата. Каков цвет полученного раствора? Может ли эта окраска обусловливаться присутствием ионов K+, I–, Hg2+? Какой из этих ионов может быть комплексообразователем? С какими лигандами он мог образовать в данном растворе сложный ион?
Этот анион можно выделить в осадок ионами серебра: в пробирку добавить 1-2 капли раствора нитрата серебра. Отметить цвет осадка и записать уравнения реакций в молекулярной и ионной формах.
Примечание: соли ртути ядовиты. Поэтому опыт проводить осторожно и затем тщательно вымыть руки.
Опыт 7. Образование гидроксокомплекса цинка. В пробирку налить 3−4 капли раствора сульфата цинка и добавить по каплям раствор гидроксида натрия, находящийся в штативе с реактивами, до выпадения осадка гидроксида цинка. Затем в вытяжном шкафу добавить по каплям 6 н. раствор едкого натра до полного растворения осадка вследствие образования комплексного аниона тетрагидроксоцинка (2−). Какое свойство гидроксида цинка иллюстрирует данный опыт? Составить уравнения реакций в молекулярной и ионной формах.
Опыт 8. Внутрикомплексные соединения. В 3 пробирки внести по 3 капли раствора хлорида железа (III). Одну оставить в качестве контрольной. В две другие добавить по 3 капли раствора щелочи. К образовавшемуся осадку в одну из них добавить 12 – 15 капель 2 н. щавелевой кислоты, в другую – столько же 2 н. лимонной кислоты СН2(СООН)–С(ОН)СООН–СН2(СООН). В обе пробирки и в контрольную внести 1 – 2 капли раствора роданида калия или аммония, который образует с ионами Fe3+ ярко окрашенный роданид железа Fe(SCN)3. Во всех ли пробирках наблюдается окрашивание?
При растворении гидроксида железа (III) в щавелевой и лимонной кислотах образуются внутрикомплексные соединения, в которых карбоксильные группы кислот присоединяются к комплексообразователю. Для щавелевокислого комплекса формула имеет вид:
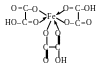
Моно- или полидентатным лигандом является остаток щавелевой кислоты? Написать аналогично формулу лимоннокислого (цитратного) комплекса. Обратить внимание на особую прочность внутрикомплексных соединений.
Реакции с участием комплексных соединений, не сопровождающиеся разрушением комплексного иона.
Это реакции обмена,
в которых комплексные ионы ведут себя
аналогично анионам кислородсодержащих
кислот, таким как
![]() ,
,
![]() и т.п.
и т.п.
Опыт 9. Образование труднорастворимого гексацианоферрата (III).
А. Налить в пробирку 3−4 капли раствора гексацианоферрата (II) калия K4Fe(CN)6. Добавить 2−3 капли раствора хлорида железа (III). Отметить окраску образующегося осадка берлинской лазури, используемой для производства художественных красок. Реакция служит для обнаружения катионов Fe3+.
Б. Налить в пробирку 3−4 капли раствора гексацианоферрата (III) калия K3Fe(CN)6. Добавить 2−3 капли раствора сульфата железа (II). Отметить окраску образующегося осадка, который в прошлом веке называли турнбулевой синью. В настоящее время установлено, что берлинская лазурь и турнбулева синь – одно и то же вещество, а именно: гексацианоферрат (III) железа (II) Fe3Fe(CN)62. Данная реакция служит для обнаружения катионов Fe2+.
Запишите уравнения всех проведенных реакций в молекулярной и ионной формах.
Опыт 10. Образование труднорастворимых гексацианоферратов (II).
Налейте в две пробирки по 3−4 капли раствора гексацианоферрата (II) калия. В первую пробирку добавьте 2−3 капли раствора сульфата цинка, во вторую – столько же раствора сульфата меди (II). Отметьте цвета образующихся осадков и запишите уравнения реакций.
Опыт 11. Образование труднорастворимого гексанитрокобальтата (III) натрия-калия. Реакция служит для обнаружения в растворах катионов калия. Налейте в пробирку 3−4 капли раствора Na3Co(NO2)6 и добавьте 2−3 капли раствора хлорида калия. Отметьте окраску образующегося осадка комплексной соли K2NaCo(NO2)6 и запишите уравнение реакции в молекулярной и ионной формах.
Реакции, сопровождающиеся разрушением комплексных ионов.
Опыт 12. Образование и разрушение амминокомплекса никеля. Налить в пробирку 3−4 капли раствора сульфата никеля (II) и добавить 2−3 капли концентрированного раствора аммиака до полного растворения образующегося в первый момент осадка сульфата гидроксоникеля. Отметить окраску раствора, обусловленную катионом гексаамминоникеля (2+). Добавить несколько капель раствора соляной кислоты концентрацией 15 % до изменения окраски. Записать уравнения реакций. Объяснить изменение окраски при переходе от аквакомплекса никеля к амминокомплексу и затем к хлорокомплексу с точки зрения теории кристаллического поля и спектрохимического ряда лигандов.
Опыт 13. Разрушение комплекса при разбавлении раствора. Выполнение работы. Внести в пробирку 2 капли раствора нитрата серебра и добавлять 0,1 н. раствор иодида калия по каплям, встряхивая пробирку после каждого добавления. Почему растворяется выпавший вначале осадок иодида серебра? К получившемуся раствору добавить 4−5 капель воды. Что наблюдается?
Описать наблюдаемые процессы. Написать уравнения реакций: образования иодида серебра, его перехода в комплексное соединение, диссоциации комплексного иона, выражение константы нестойкости. Какое влияние оказывает разбавление раствора на диссоциацию комплексного иона?
Опыт 14. Разрушение комплекса при осаждении комплексообразователя. В две пробирки с раствором сульфата меди добавить: в одну раствор оксалата аммония, в другую − сульфида натрия. Написать уравнения реакций и отметить цвета выпавших осадков. В двух других пробирках получить комплексное соединение меди, добавив к 4−5 каплям раствора CuSO4 раствор аммиака до растворения выпадающего вначале осадка основной соли меди. Отметить цвет полученного комплексного соединения. Написать уравнение реакции взаимодействия сульфата меди с аммиаком, учитывая, что координационное число меди равно четырем.
Испытать действие растворов оксалата аммония и сульфида аммония на полученный раствор комплексной соли меди. От действия какого реактива выпадает осадок? На присутствие каких ионов в растворе комплексной соли указывает появление этого осадка? Добавить в пробирку, где выпал осадок, еще 6−7 капель того же реактива и для ускорения коагуляции поместить пробирку в водяную баню, нагретую до кипения. Сохранилась ли в растворе окраска комплекса меди?
Описать наблюдаемые явления. Ответить на поставленные по ходу работы вопросы. Написать уравнения проделанных реакций, уравнение электролитической диссоциации комплексной соли меди и ее комплексного иона. Как влияет добавление (NH4)2S на диссоциацию комплексного иона?
Сравнить произведения растворимости соответствующих солей меди и объяснить, почему одна из них не выпадает в осадок из комплексного соединения.
Опыт 15. Гидратная изомерия аквакомплексов хрома (III). Хлорид хрома СrСl3·6Н2О образует изомеры различного цвета: сине-фиолетовый [Сr(Н2О)6]Сl3; темно-зеленый [Сr(Н2О)5С1]С12·Н2О и светло-зеленый [Сr(Н2О)3Сl3]·3Н2О. В растворах все три изомера находятся в равновесии, состояние которого зависит от различных факторов, в частности, сильно зависит от температуры.
В две пробирки поместить по несколько кристалликов хлорида хрома СrСl3·6Н2О и по 10 капель воды. Одну пробирку оставить в качестве контрольной, вторую нагреть на кипящей водяной бане и наблюдать изменение окраски. Какой изомер аквакомплекса хрома (III) преимущественно устойчив при комнатной температуре? При высокой температуре?
Дать рациональные названия всех трех приведенных изомеров.
Опыт 16. Комплексные соединения в окислительно-восстановительных реакциях.
А. Восстановление серебра из его комплексного соединения. Добавить в пробирку к 5−6 каплям раствора нитрата серебра раствор хлорида натрия. Полученный осадок растворить в концентрированном растворе аммиака. Опустить в раствор кусочек гранулированного цинка. Что наблюдается?
Написать уравнения: получения осадка хлорида серебра, его растворения в аммиаке с образованием комплекса серебра и взаимодействия полученного комплексного соединения с цинком. Какой ион является окислителем в последней реакции? Написать уравнение электролитической диссоциации комплексного иона и ионное уравнение окислительно-восстановительной реакции.
Б. Восстановление гексацианоферрата (III) калия. В пробирку внести 4−5 капель раствора иодида калия, 3−4 капли 2 н. раствора хлороводородной кислоты и 2−3 капли бензола. Отметить, что бензол остается бесцветным. Добавить один микрошпатель кристаллов комплексной соли железа (III) K3[Fe(CN)6] и перемешать раствор стеклянной палочкой. По изменению окраски бензола убедиться в выделении свободного иода.
Написать уравнение реакции взаимодействия гексацианоферрата (III) калия с иодидом калия, учитывая, что K3[Fe(CN)6] переходит при этом в K4[Fe(CN)6]. (Кислоту в уравнение реакции не вводить). Указать окислитель и восстановитель.
В. Окисление гексацианоферрата (II) калия. Поместить в пробирку 4−5 капель раствора перманганата калия, подкислить 2 н. серной кислотой и добавить по каплям раствор гексацианоферрата (II) калия до обесцвечивания раствора.
Написать уравнение реакции, учитывая, что комплекс железа (II) переходит в комплекс железа (III) с тем же координационным числом, а перманганат калия в кислой среде восстанавливается до сульфата марганца (II).
Протокол лабораторной работы
По каждому опыту записать используемые при проведении эксперимента реактивы и результаты проведения реакций: образование осадка, выделение газа, изменение цвета раствора и т.д.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, ответы на вопросы.
Лабораторная работа № 11. Определение энтальпии реакции нейтрализации
Цель работы: ознакомиться с принципами и практическими приемами определения теплового эффекта реакции нейтрализации. Измерение теплового эффекта реакции основано на первом начале термодинамики. Для определения теплового эффекта реакции необходимо знать теплоемкость системы Сcal и вызванное реакцией изменение температуры Т.
Общие сведения
Реакция нейтрализации представляет взаимодействие оснований с кислотами, например, NaOH + HCl = NaCl + H2O. В ионной форме должна быть выражена уравнением H+ + OH− = H2O. Образование из ионов Н+ и OH− молекул воды сопровождается выделением значительного количества тепла.
Сильные кислоты и сильные основания в достаточно разбавленных растворах диссоциированы полностью, поэтому общий тепловой эффект реакции нейтрализации для них обусловлен образованием молекул воды из ионов и теплота процесса должна быть близка к стандартной теплоте нейтрализации, вычисленной по закону Гесса.
Слабые кислоты и
основания в растворе представлены
преимущественно молекулами. Значение
теплоты нейтрализации может существенно
отличаться от стандартного значения.
В этом случае процесс можно разделить
на стадии: диссоциация слабого электролита,
гидратация ионов
![]() и собственно нейтрализация
и собственно нейтрализация
![]() .
Тепловой эффект реакции является суммой
перечисленных процессов и к теплоте
нейтрализации сильного электролита
.
Тепловой эффект реакции является суммой
перечисленных процессов и к теплоте
нейтрализации сильного электролита
![]() следует добавить эндотермический эффект
диссоциации слабого электролита
следует добавить эндотермический эффект
диссоциации слабого электролита
![]() и экзотермический эффект гидратации
катиона и аниона
и экзотермический эффект гидратации
катиона и аниона
![]() :
:
![]() .
.
