
1 .Методы изучения первичной структуры белка
Методы изучения строения белков
Полный гидролиз либо в щелочной, либо в кислой среде.
Кислотный гидролиз проводят в течение 24 часов при t= 110 6-NHCl. Продукты гидролиза разделяются методом ионообменной хроматографии (на колонке) с сульфолированным полистиролом. Фракцинирование аминокислоты: с помощью нингидрона по окраске определяют количество аминокислоты. Затем вымывают и фотометрически определяют каждую аминокислоту. Таким образом можно определить легкие аминокислоты (отпечатки пальцев). Если белков малое количество 10-9, то используют реактив- флуорескамин.

Определение аминокислотной последовательности.
Надо убедиться,
что цепь одна.



1.Метод Сенгера:опред. одну АК сN-конца

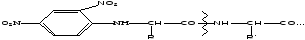
Можно использовать дансилхлорид
(так же как и в предыдущей р-ции только по хлору)

2. Метод Эдмана – позволяет определить с N-конца десятки аминокислот

Эдман сконструировал прибор– секвенатор. белок помещен в виде тонкой пленки во вращающейся цилиндр. сосуд, где он подвергается расщеплению Расшифровал 60 аминокислот с N-конца миоглобина кита.
3.Определение 1-ой аминокислоты с с-конца гидразином.

4.Фермент карбоксипептидазы может последовательно отщеплять по 1-ой аминокислоте с С-конца.Используют для определения небольших полипептидов (до 100)
Если больше 100.
Трепсин– расщепляет пептидные связи, образованные с С-концом основных аминокислот – лизина и аргенина.
Хемотрепсин– расщепляет пептидную связь с с-конца ароматических и дикарбоновых кислот.
Разделяют хроматоргафически, начинают определять. Берут снова порцию полипептида. Расщепляют другим способом, с помощью химического реагента, используют бромциан – расщепление с С-конца метиламина. Смотрят, перекрывающиеся участки сопоставляют.
Гидроксиламин–NH2OH- расщепляет связь аспарагин-глицин.
2-нитро-5тиоцианобензоат – расщепляет там где аминогруппа цистоина.
1953 г. – инсулин – самая 1-ая последовательность. Иммуноглобулин (4 полипептидные цепи) – самый крупный 1300 аминокислотных остатков.
В белках могут быть определены все аминокислоты.
Метод отпечатков пальцев
Бромциан расщипляет с С-конца метиамина(в 90% HCOOH)
Определение последовательности нужно для:
1) Для выявления молекулярной основы биол. активности.
2) Как первичная структура влияет на втор- трет- и четвертичную.
3) Изменение в последовательности может привести к заболеванием (наследственные).
4) Данные о белковой последовательности могут многое сказать об эволюции.
2 РНК
РНК- Н3РO4; Рибоза; Аденин; Гуанин; Цитозин; Урацил



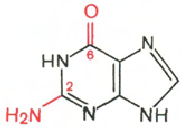
Цитозин Урацил Аденин Гуанин
Углеводы (рибоза и дезоксирибоза) в молекулах ДНК и РНК находятся в β-D-рибофуранозной форме:

D-рибоза β-D-рибофураноза
О количестве РНК нет точных данных, поскольку содержание ее в разных клетках в значительной степени определяется интенсивностью синтеза белка. На долю РНК приходится около 5–10% от общей массы клетки. Современная классификация различных типов клеточной РНК основывается на данных топографии, функции и молекулярной массы. Выделяют три главных вида РНК: матричную (информационную) – мРНК, которая составляет 2–3% от всей клеточной РНК; рибосомную – рРНК, составляющую 80–85% и транспортную – тРНК, которой около 16%. Эти 3 вида различаются нуклеотидным составом и функциями.
Матричная РНКобразуется в процессе транскрипции. Она несет точную копию генетической информации, закодированной в определенном участке ДНК, а именно о последовательности аминокислот в белках.
Матричная РНК (мРНК) синтезируется в ядре на матрице ДНК, затем поступает в рибосому, выполняя матричную функцию при синтезе белка. мРНК при поступлении из ядра в цитоплазму образует со специфическими РНК-связывающими белками комплексы – так называемые информосомы, способные к обратимой диссоциации. Информосомы рассматриваются как транспортная форма мРНК, способствующая образованию полирибосом в цитоплазме.
Транспортные
РНК(тРНК) имеют небольшую молекулярную
массу и содержатся в растворимой фракции
цитоплазмы, выполняя функцию переноса
аминокислот к месту белкового синтеза
– рибосоме. Молекула тРНК представляет
собой одиночную полинуклеотидную цепь,
закрученную «на себя». Все тРНК построены
по одному плану, все они укладываются
в модель «клеверный лист». Главный
принцип – образование максимального
числа водородных связей между азотистыми
основаниями. «Клеверный лист» содержит
пять спирализованных стеблей, четыре
из которых заканчиваются петлями из
неспаренных нуклеитидов. В центре
молекулы находится неспирализованная
область. 3’ и 5’ – концы полинуклеотидной
цепи спарены , образуют акцептирующий
стебель. Противостоит акцептирующему
стеблю антикодоновый стебель. Он несет
антикодоновую петлю, которая состоит
из 7 нуклеотидов. Антикодоновая петля
содержит в своей средней части антикодон,
состоящий из 3 нуклеотидов, комплементарный
кодону данной аминокислоты в мРНК. Петля
псевдоуридина , которую несет Т - стебель,
содержит минорный компонент псевдоуридин.
Она состоит из 7 нуклеотидных остатков.
Предполагают, что именно этой петлей
тРНК взаимодействует с рибосомой.D– стебель несет петлю из 8-12 нуклеотидов.
Это петля дигидроуридина, в ней всегда
содержится несколько остатков минорного
компонента дигидроуридина.
Рибосомная РНК- та основа, на которой располагаются белки, образуя рибосому. Рибосомы локализуются главным образом в цитоплазме, кроме того,- в ядре митохондриях и хлоропластах. Нуклеотидный состав сходен: преобладают гуаниловые нуклеотиды , уридиловые и цитидиловые – находятся в малых количествах, минорных оснований нет. По размерам и молекулярной массе рибосомы делят:
Бактериальные рибосомы (относительно мелкие). Константа седиментации 70S.
Рибосомы эукариотических клеток. Константа седиментации 80S.
Рибосомы митохондрий и хлоропластов.
При гидролизе РНКобразуются рибоза, аденин, гуанин, урацил, цитозин, фосфорная кислота.
