
Стоматология детского возраста - Персин9 / Раздел 12. Опухоли и опухолеподобные образования мягких тканей и костей лица / 12.3.6. Злокачественные опухоли челюстных костей
.doc12.3.6. Злокачественные опухоли челюстных костей
Злокачественные опухоли ЧЛО в детском возрасте относятся чаще всего к группе неэпителиальных и могут развиваться из собственно костной ткани, соединительной ткани костного мозга, тканей, окружающих челюстные кости.
С позиции онкологической настороженности детский стоматолог обязан при подозрении на проявление злокачественной опухоли у ребенка, правильно оформив документацию, безотлагательно направить его в специализированное онкологическое лечебное учреждение для уточнения или установления диагноза и проведения лечения.
Из практики должен быть полностью исключен этап «наблюдения» больного ребенка. Слабое знание основных клинических признаков проявления злокачественных опухолей у детей приводит к неоправданным действиям, задерживающим своевременную диагностику. Объективными причинами сложности диагностики этих видов новообразований являются относительно малое число больных и бессимптомность начального этапа заболевания.
Лечение злокачественных опухолей комплексное, проводят его в специализированных онкологических лечебных учреждениях.
В этом разделе рассмотрены диагностические симптомы отдельных злокачественных опухолей челюстных костей, встречающихся у детей.
Остеогенная саркома — одна из чрезвычайно злокачественных опухолей, исходящая из собственно костной ткани. Она развивается из соединительной ткани, способной к образованию опухолевого остеоида и кости. В ней преобладают остеоциты, подвергшиеся озлокачествлению.
Клиническая картина. Начальные симптомы болезни обычно не улавливаются, так как появляются незаметно. Нередко заболевание обнаруживается в связи с травмой.
В одних случаях первым проявлением заболевания может быть боль в одном из интактных зубов, в других — неприятный зуд в области десневого края, расшатывание зубов. Иногда до появления болей отмечается нарушение чувствительности (парестезия) в области разветвления подглазничного или подбородочного нерва, причем парестезии могут быть непостоянными и скоропреходящими.
Болевой симптом при остеогенных саркомах верхней челюсти в отличие от таковых нижней челюсти является довольно поздним признаком болезни. Наличие воздухоносной верхнечелюстной пазухи дает возможность длительного беспрепятственного и незаметного роста опухоли. В связи с этим остеогенные саркомы и другие злокачественные новообразования верхней челюсти диагностируются в более поздние сроки, чем нижней. Несмотря на значительный размер опухоли, в ряде случаев боли могут отсутствовать.
Другим клиническим признаком остеогенных сарком служит появление на месте их развития припухлости различной величины и плотности, умеренно болезненной при пальпации.
При больших опухолях отмечается «отечность» мягких тканей, расширяются подкожные и подслизистые вены, кожа над опухолью истончается. Если остеогенная саркома развивается вблизи ВНЧС, открывание рта резко ограничивается.
Общее состояние больных с остеогенной саркомой в первые месяцы не ухудшается, но впоследствии, когда опухоль достигает значительного размера, температура тела повышается до 39—40 °С, увеличивается СОЭ, что свидетельствует о распаде опухоли. У детей болезнь развивается стремительно, имеет короткое и бурное течение.
При быстротекущих формах длительность заболевания не превышает 6 мес. За этот срок опухоль достигает значительного размера. Стойкое излечение достигается лишь у немногих. Метастазы в легких возникают раньше, чем в других органах.
Рентгенологически эти опухоли в основном характеризуются преобладанием в них то разрушительных, то созидательных процессов. В соответствии с этим остеогенные саркомы принято подразделять на остеолитические, остеопластические и смешанные формы.
Остеолитической остеогенной саркоме свойственно значительное разрушение кости. На рентгенограмме челюсти определяется участок деструкции кости в виде бесструктурного дефекта с неровными, зазубренными, как бы изъеденными контурами. Наружная граница дефекта отсутствует и сливается с тенью окружающих мягких тканей.
При остеопластической остеогенной саркоме преобладают явления патологического костеобразования. Рентгенологически опухоль в начальных стадиях представляет собой небольшой, нечетко очерченный очаг уплотнения кости с выраженным изменением надкостницы в виде симптома козырька, а затем в виде игольчатого периостита. Этот тип опухолей чаще встречается у детей и подростков, а остеолитиче-ский — у взрослых с ослабленной по сравнению с молодыми людьми регенеративной способностью кости.
Кроме рентгенологического метода исследования, применяют МРТ и КТ, что позволяет точно определить область распространения опухоли, особенно за пределами кости. Метастазирование остеогенной саркомы происходит в первую очередь в легкие, затем в кости. Метастазы в лимфатические узлы не типичны. Предполагается, что метастазирование начинается через 4—6 мес от начала заболевания.
Дифференциальный диагноз остеогенной саркомы челюсти в типичных, особенно в далеко зашедших случаях, не представляет затруднений. Однако распознавание опухоли значительно труднее в начальных стадиях заболевания, когда установить диагноз без данных биопсии невозможно.
Подозрение на остеогенную саркому могут вызвать литическая форма гигантоклеточной опухоли, фиброзная дисплазия, саркома Юинга, десмопластическая фиброма.
Лечение комплексное — противоопухолевая химиотерапия и оперативное вмешательство. Объем хирургического лечения и возможность радикального удаления опухоли зависят от ее локализации и размера. Хирургическое лечение, когда это возможно, необходимо сочетать с восстановительными операциями.
Фибросаркома может наблюдаться у детей как младшего, так и старшего возраста. Фибросаркома кости челюсти может быть центральной и периферической. Периферические, или периостальные, фибросаркомы возникают из надкостницы, расположены вне кости и растут преимущественно в сторону мягких тканей, окружающих челюсть, или в полость рта; центральные развиваются в толще кости из соединительнотканной стромы костного мозга.
Клиническая картина. При периостальных фибросаркомах больные в первую очередь жалуются на постепенно увеличивающуюся припухлость. По мере роста опухоли могут появиться боли. В начальных стадиях выявляются незначительное покраснение слизистой оболочки, неприятные ощущения или нерезкая болезненность при пальпации. Позднее возникает припухлость, обусловленная утолщением надкостницы.
Припухлость медленно увеличивается, достигая иногда довольно большого размера. При поражении верхней челюсти возможны сужение глазной щели, деформация крыла носа, сглаженность носогубной борозды и ограниченное открывание рта. Последнее свидетельствует о распространении опухоли в крыловидно-челюстное пространство.
Периостальные фибросаркомы верхней челюсти в отличие от таковых нижней челюсти более злокачественны, а рентгенологически многообразны и нетипичны. Периостальная фибросаркома нижней челюсти рентгенологически выявляется в виде довольно четко очерченного однородного образования неправильной круглой или овальной формы, расположенного на кости. Поверхность кости в месте прилежания опухоли приобретает дефект дугообразной формы с ровными гладкими контурами в истонченном кортикальном слое челюсти. Иногда наблюдаются шиловидные периостальные наслоения. Периостальную фибросаркому дифференцируют в первую очередь от десмопластической фибромы.
У больных с центральной фибросаркомой ко времени обращения к врачу в толще кости пораженной челюсти обычно определяются значительные деструктивные изменения. Они имеют вид пятнисто-очаговой перестройки кости или однородного, нечетко очерченного остеолитического очага.
Лечение комплексное.
Саркома Юинга относится к костным опухолям, но она развивается из неостеогенной ткани. Эта опухоль встречается преимущественно у детей в возрасте 9—13 лет, но может наблюдаться в младшей возрастной группе (до 5 лет).
Клиническая картина. Заболевание может начинаться лихорадкой, с приступа ноющих, тупых болей в пораженной области, к которым вскоре присоединяются подвижность зубов, припухлость мягких тканей, окружающих челюсть, и повышение температуры тела до 39—40 °С. Наряду с общим недомоганием и нарастающей слабостью временами отмечается лихорадочное состояние. В крови обнаруживаются лейкоцитоз, повышение СОЭ, а иногда вторичная анемия. Характерна цикличность заболевания.
Наряду с общими явлениями у многих больных кожа и слизистая оболочка, покрывающая опухоль, умеренно гиперемированы, горячие на ощупь, напряжены. Возможна псевдофлюктуация. По истечении некоторого времени боли стихают и даже исчезают, припухлость становится менее выраженной, а подвижность зубов несколько уменьшается, но затем болезнь обостряется с новой силой. Опухоль то увеличивается, то уменьшается. Таким образом, в начале заболевания клиническая картина практически не отличается от картины острого одонтогенного остеомиелита. Волнообразное течение болезни характерно для саркомы Юинга, и это симулирует остеомиелит. Ошибочный диагноз остеомиелита типичен для опухоли Юинга. Для саркомы Юинга характерна способность метастазировать в регионарные и более отдаленные лимфатические узлы, а также в другие кости.
Множественные метастазы могут появиться уже в первые месяцы после начала заболевания и симулировать первично-множественную локализацию злокачественной опухоли. Этим опухоль Юинга отличается от остеогенной саркомы, которая, как правило, остается солитарной и только в исключительных случаях дает метастазы в другие отделы скелета. Характерным и диагностически важным признаком является нахождение метастазов в регионарных лимфатических узлах, что не наблюдается при остеогенной саркоме.
Рентгенологически саркома Юинга в челюстных костях проявляется в виде деструктивных изменений. Последние характерны не только для этой опухоли. Они могут наблюдаться и при других новообразованиях: ретикулярной саркоме, эозинофильной гранулеме, остео-генной саркоме и метастазах симпатобластомы. Вопрос об истинной природе опухоли не может быть решен без ее гистологического исследования.
В отличие от поражения трубчатых костей при поражении челюсти опухолью Юинга периостальное костеобразование отсутствует.
Лечение. Саркома Юинга в отличие от других злокачественных опухолей челюстных костей высокочувствительна к лучевому воздействию и противоопухолевым препаратам. Путем сочетания лучевой и полихимиотерапии можно добиться стойкого излечения не только первичной опухоли, но и ее метастазов. Консервативная химиолучевая терапия позволяет достигнуть стойких результатов при своевременном лечении.
Ретикулярная саркома чаще наблюдается у детей младшего возраста. Заболевание протекает медленно и на первых стадиях доброкачественно. Опухоль длительное время остается одиночной и не выходит за пределы разрушаемой кости. Временами, как и при саркоме Юинга, могут наблюдаться сопутствующие местные воспалительные явления с повышением температуры тела и СОЭ, умеренным лейкоцитозом. Общее состояние детей, даже при обширных опухолях, длительное время остается хорошим.
Характерно несоответствие между состоянием больного и значительными изменениями, определяемыми в кости на месте ее поражения. Нередко больные впервые обращаются к врачу через 6 мес после появления первых клинических признаков опухоли. У детей младшего возраста течение процесса бурное.
Заболевание осложняется развитием метастазов в легких, а также в лимфатических узлах и костном аппарате.
Рентгенологическая картина ретикулярной саркомы челюстей многообразна. Нередко деструкция кости челюсти на рентгенограмме имеет пятнистый характер за счет большого количества округлых или овальных очагов без четких границ (рис. 12.35, а, б). Ретикулярную саркому дифференцируют от литической, остеогенной саркомы, эозинофильной гранулемы, остеомиелита и периостита.
Лечение. Радиочувствительность ретикулосарком обусловливает широкое применение лучевой терапии в качестве самостоятельного метода лечения. Мегавольтную лучевую терапию осуществляют на дистанционных гаммаустановках, линейных ускорителях, бетатронах. Лечение комплексное и может привести к стойкой ремиссии.
Реабилитация больных после удаления опухолей. Дефекты костей лица, образовавшиеся после удаления новообразований, вызывают психоэмоциональные анатомические и функциональные нарушения, которые с возрастом усугубляются. Развиваются вторичные деформации костей лица.
Возмещение дефектов костей лица одномоментно с удалением опухоли необходимо и оправдано в любой период детского возраста.
Следует обратить внимание на предоперационную общую и специальную подготовку пациента к первичной, повторной или отсроченной костной пластике нижней челюсти.
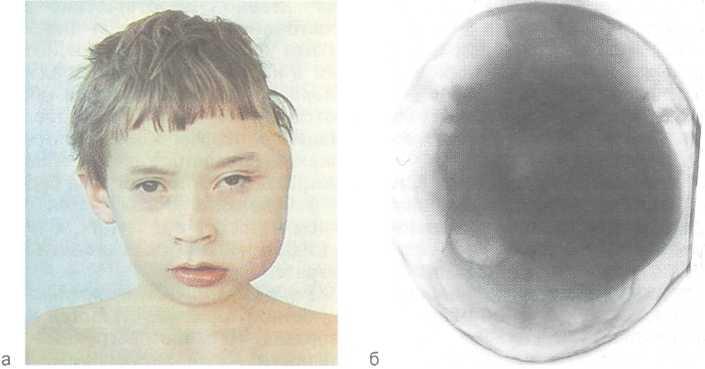
Рис. 12.35. Ретикулярная саркома верхней челюсти, скуловой кости и височной
области.
а — внешний вид ребенка; б — рентгенограмма (очаг деструкции).
Общая подготовка ребенка к костной пластике предусматривает:
1) тщательный анализ катамнеза, при необходимости специальную общесомати-ческую подготовку;
2) выделение группы заболеваний, при которых проведение костной пластики нецелесообразно (активные формы туберкулеза, сахарный диабет, системные костные заболевания, болезни крови, хронические заболевания паренхиматозных органов в стадии декомпенсации);
3) выявление заболеваний, требующих обязательного лечения в предоперационном периоде (воспалительные заболевания ЛОР-органов, острые и хронические заболевания верхних дыхательных путей, гиповитаминозы, анемия и др.).
К специальным мероприятиям относятся:
1)санация полости рта: лечение кариеса, его осложнений, снятие зубных отложений, удаление молочных зубов с резорбированными корнями, лечение заболеваний и травматических повреждений слизистой оболочки не менее чем за 3—4 нед до костной пластики;
2) клиническое и рентгенологическое исследования костей лицевого скелета и нижней челюсти для определения протяженности будущего или имеющегося дефекта (ортопантомограмма и обзорная рентгенограмма костей лица в прямой проекции, томографическая рентгенограмма (ТГР), рентгенограмма левой кисти, по отдельным показаниям КТ, построение трехмерного изображения, стереолитографическое моделирование);
3) изготовление контрольных гипсовых моделей, по которым также можно определить величину дефекта, степень деформации челюстей, зубных рядов, положение зубов; проведение расчета требуемой степени «гиперкоррекции» размеров трансплантируемой костной ткани;
4) фотографирование больного до и после операции;
5) подбор трансплантата с учетом возраста ребенка и вида костной пластики, выбор способа фиксации трансплантата в костной ране;
6) выбор иммобилизирующего аппарата и его изготовление.
Немаловажным является и лечение после реконструктивно-восстановительных операций, которое предусматривает:
1) послеоперационную симптоматическую терапию и профилактику инфекций;
2) иммобилизацию челюстей до 30 дней, наблюдение за ушитой раной и ребенком;
3) клинико-рентгенологический контроль за качеством формирования регенерата через 10, 30, 60, 90, 120, 180, 360 дней и далее;
4) ортодонтическое лечение и рациональное протезирование через 3—6 мес;
5) диспансерное наблюдение до окончания роста костей лицевого скелета с ортодонтической коррекцией состояния зубов, протезированием, в том числе с опорой на имплантаты после 16—18-летнего возраста.
Реабилитация детей после резекции верхней челюсти. При удалении новообразований костей лицевого скелета в области средней зоны лица образуются сложные дефекты, которые могут включать в себя анатомо-функциональное объединение трех комплексов: носоверхнечелюстного, ротовой полости и полости глазницы.
Основная цель реабилитации детей с дефектами средней зоны лица — восстановление анатомо-функциональных взаимоотношений между этими тремя комплексами. Однако сложный рельеф средней зоны лица, ограниченные возможности использования пластического материала являются основными проблемами при реконструкции костей этой зоны.
При удалении опухолей верхней челюсти выполняют резекцию альвеолярного отростка или тела челюсти с опухолью единым блоком.
Дефекты челюстей могут сочетаться с нарушением целостности носоверхнечелюстного и глазничного комплексов.
В зависимости от объема удаленных тканей дефекты костей верхней челюсти укрывают оставшимся мягкотканным компонентом или выполняют дефект тампоном. Дальнейшая реабилитация таких пациентов заключается в раннем протезировании. Раннее зубочелюстное протезирование преследует цели: а) формирование будущего протезного ложа; б) предсказуемое формирование рубцов; в) профилактику вторичных деформаций костей лица, зубных рядов; г) предупреждение нарушений речи и жевания; д) восстановление взаимоотношений между носоверхнечелюстным комплексом, ротовой полостью и полостью глазницы.
Протезирование осуществляют съемным пластиночным протезом с кламмерной фиксацией. После эпителизации раны вначале изготавливают фиксирующуюся часть съемного протеза вместе с зубами, затем обтурационную часть. Пациент пользуется таким протезом в течение 3—6 мес. Периодически (1 раз в месяц) проводят осмотр полости рта и коррекцию протеза. Через 3—6 мес назначают этапное отдаленное протезирование. Диспансерное наблюдение у хирурга и ортодонта обязательны. С ростом костей лицевого скелета проводят этапное повторное протезирование.
Раннее и отдаленное многоэтапное протезирование дефектов в области верхней челюсти восстанавливает функции жевания, глотания, дыхания, речи и анатомо-функцио-нальные взаимоотношения между носоверхнечелюстным комплексом, ротовой полостью и полостью глазницы. Дальнейшая реабилитация пациентов зависит от возраста и выбора оптимального оперативного вмешательства. Контурную пластику проводят с учетом клинико-функциональных и эстетических предпосылок.
Реабилитация детей после удаления опухолей нижней челюсти. Дефекты нижней челюсти вызывают нарушения функции жевания, мимики, речи, дыхания, моральные страдания больных и их близких, поэтому их возмещение после удаления новообразований является важной задачей детской челюстно-лицевой хирургии и должно проводиться как первичная операция, т.е. после удаления опухолей дефекты должны быть возмещены трансплантатами различного вида.
Одной из наиболее актуальных проблем, возникающих при лечении таких больных, является выбор пластического материала с учетом множественных морфофункциона-льных особенностей детского организма.
Трансплантат должен быть механически стабильным, малотоксичным, биосовместимым, обладать остеоинтегративными и остеоиндуктивными свойствами, способностью активно перестраиваться, позволять воспроизводить форму и размеры возмещаемого фрагмента, доступностью в получении и хранении. Костная пластика нижней челюсти у детей эффективна и оправдана в любом возрасте, но требует различной степени гиперкоррекции трансплантата. Таким способом создается запас «роста» на стороне дефекта. При реконструкции нижней челюсти в растущем организме немаловажными становятся выбор метода пластики, планирование ее последовательности, объем, этапность с учетом этиологии и патогенеза заболевания в полном соответствии с анатомо-функциональными особенностями развития ребенка, хронологического и биологического возраста.
Применяются аллогенные и комбинированные аутоаллогенные трансплантаты, аутотрансплантаты, комбинированные, лиофилизированные, формалинизированные аллотрансплантаты в сочетании с деминерализованным матриксом и гидроксиапатитом, аутотрансплантаты на сосудистом анастомозе, эндопротезы.
Костная пластика аллогенными тканями. В последние десятилетия в детской челюстно-лицевой хирургии широко используются аллотрансплантаты, стерилизованные и консервированные различными способами, полученные от специального донора. В настоящее время применяют лиофилизированные, замороженные, формалинизированные и деминерализованные аллогенные ткани.
Резекция челюсти может быть сегментированной или с экзартикуляцией. При доброкачественных новообразованиях следует сохранить не измененные опухолевым процессом надкостницу и ВНЧС.
У детей до 10—12-летнего возраста целесообразно использовать монолитные кортикальные трансплантаты, а после 12 лет — аналогичные (из нижней челюсти).
Образовавшееся сообщение раны с полостью рта тщательно ушивают минимум двумя рядами швов долго рассасывающимся материалом типа «Vicryl», «PGA Resorba» и др. Оставшийся фрагмент нижней челюсти устанавливают при помощи заранее изготовленного позиционера в положение просчитанной гиперкоррекции и проводят жесткую иммобилизацию. Рану обрабатывают антисептиками и антибиотиками. Операционный стол и операционное поле перекрывают, хирургическая бригада меняет медицинские халаты и перчатки. Затем подготавливают воспринимающее ложе для трансплантатов. Для этой цели фрезой с охлаждением снимают наружную кортикальную пластинку со стороны дефекта на расстоянии 1 — 1,5 см, подгоняют ее по размеру дефекта и воспринимающих трансплантат площадок. В трансплантате формируют зеркальное отображение воспринимающей площадки донорского ложа. Фиксацию трансплантата осуществляют при помощи титановых саморезов, винтов или мини-пластин и саморезов. Если резекция челюсти сопровождается отслойкой жевательных мышц, то их подшивают к краю трансплантата. Для улучшения остеоинтегративных свойств аллот-рансплантата в детской челюстно-лицевой хирургии применяют комбинированные ткани — алло-генный материал в сочетании с гидроксиапатитом. После фиксации аллогенного трансплантата фрагменты деминерализованной костной ткани укладывают вдоль трансплантата и фиксируют резорбируемым материалом. Образовавшиеся промежутки заполняют гранулами гидроксиапатита. Рану послойно ушивают, оставляя в ней резиновый выпускник, накладывают асептическую повязку.
В последние годы аллогенные ткани применяют реже из-за опасности переноса реципиенту инфекции (СПИД, гепатит и др.).
Костная пластика аутотрансплантатом. В последнее десятилетие при реконструкции нижней челюсти в детской челюстно-лицевой хирургии шире применяют аутотрансплантаты. Первичная костная пластика аутотрансплантатами в детском возрасте показана после резекции нижней челюсти по поводу доброкачественных новообразований, когда имеется достаточно мягких тканей и слизистой оболочки полости рта для свободного укрытия трансплантата.
Для этой цели используют материал гребешка подвздошной кости, ребра, трансплантат из малоберцовой кости на сосудистом анастомозе и др. Костно-хрящевой фрагмент реберного трансплантата чаще применяют при пластике дистальных отделов нижней челюсти. При не-
благоприятных условиях воспринимающего ложа, особенно при повторных восстановительных операциях, когда имеется недостаток мягких тканей, слизистой оболочки полости рта, альтернативным является применение васкуляризированного аутотрансплантата на сосудистом анастомозе из малоберцовой кости у детей не ранее 12 лет. В более младшем возрасте при невозможности проведения первичной костной пластики в области дефекта оставляют проводники из титановой макропластины и др.
Операцию выполняют две бригады хирургов.
При отсроченной костной пластике успех операции во многом зависит от правильно сформированного воспринимающего ложа. Рану необходимо максимально освободить от рубцов, склерозированной костной ткани на концах фрагментов нижней челюсти, сформировать воспринимающее мягко-тканное ложе. Фрагменты нижней челюсти при помощи назубного ретейнера фиксируют в положении гиперкоррекции к верхней челюсти при помощи резиновых колец или лигатурной проволоки. Фрагменты между собой объединяют изогнутой по форме и размеру микроплатой и замеряют линейкой длину дефекта. Одномоментно вторая бригада готовит доступ к донорскому участку и по размеру проводит забор ткани.
Наиболее часто в детской челюстно-лицевой хирургии для реконструкций нижней челюсти используют гребешок подвздошной кости. В зависимости от формы и размера участок гребешка можно взять вместе с хрящевой частью края гребня. Иногда хрящевой край оставляют, а забор производят фрагментарно в виде окошка. Для этой цели при помощи режущей фрезы и изогнутого долота с охлаждением выпиливают участок гребешка. Костные края сглаживают, гемостаз проводят методом сдавливания костных краев раны, иногда с помощью воска. Рану послойно ушивают, дренируют при помощи резинового выпускника или активного дренажа. Пациенту назначают постельный режим в течение 4—6 дней.
Полученный трансплантат подгоняют к воспринимающему ложу. Нередко донорский участок фрагментируется на 2—3 фрагмента с целью воссоздать сложную необходимую форму дефекта нижней челюсти. Фрагменты укладывают в воспринимающее ложе и фиксируют шурупами к мини-пластине. Участки контакта фрагментов плотно заполняют губчатым веществом кости. Окончательную фиксацию фрагментов проводят наложением второй мини-пластины. Рану послойно ушивают, дренируют.
Костно-хрящевой реберный трансплантат. Реберный трансплантат у детей довольно легко расщепляется, и фиксацию шурупами и мини-пластинами нужно проводить без применения силовых воздействий во избежание разволокнения и размоз-жения фрагментов ребра в области прилегания.
Костная пластика комбинированными трансплантатами. При отсроченной и повторной костной пластике всегда создаются неблагоприятные условия со стороны воспринимающего ложа, а частота осложнений достигает 42,4—60 %, что связано с особенностями воспринимающего ложа и проявлениями биологической активности аллотрансплантата. Процессы рассасывания трансплантата происходят значительно быстрее костеобразования, поэтому целесообразно использовать комбинированные трансплантаты.
