
Теория активированного комплекса (переходного состояния)
Основное положение теории абсолютных скоростей химических реакций состоит в том, что всякая химическая реакция протекает через образование некоторого переходного состояния (активированного комплекса), которое затем распадается на продукты данной реакции.
Активированный комплекс существует около 10-12 - 10-13 с
Активированный комплекс не является реальным промежуточным соединением. Он представляет собой молекулу в процессе разрыва старых и образования новых связей.
Рассмотрим процесс взаимодействия атома D с молекулой A-B по реакции:
![]()
![]() -
переходное состояние или активированный
комплекс.
-
переходное состояние или активированный
комплекс.
В процессе реакции происходит сближение двухатомной молекулы AB с атомом D
конфигурация атомов (AB+D) переходит в (A+BD)
путем непрерывного изменения межатомных расстояний
(сближение молекул)
В процессе сближения наступает момент, когда молекула AВ настолько деформирована, что ее нельзя считать стабильной молекулой, а молекула BD еще не образовалась.
Систему можно считать состоящей из трех связанных между собой атомов, т.е. как промежуточный или активированный комплекс
промежуточная конфигурация атомов (A+B+D)
связь A-B ослаблена, но еще не полностью разорвана
связь B-D уже начала образовываться
Активированный комплекс может распадаться как на молекулы продукта, так и исходных соединений
При изменении межатомных расстояний изменяется потенциальная энергия системы.
По мере сближения частиц энергия системы возрастает до максимума
Затем по мере образования продуктов реакции энергия снижается и достигает значения, характерного для продуктов данной реакции
Изменение энергии реагирующих молекул иллюстрирует график
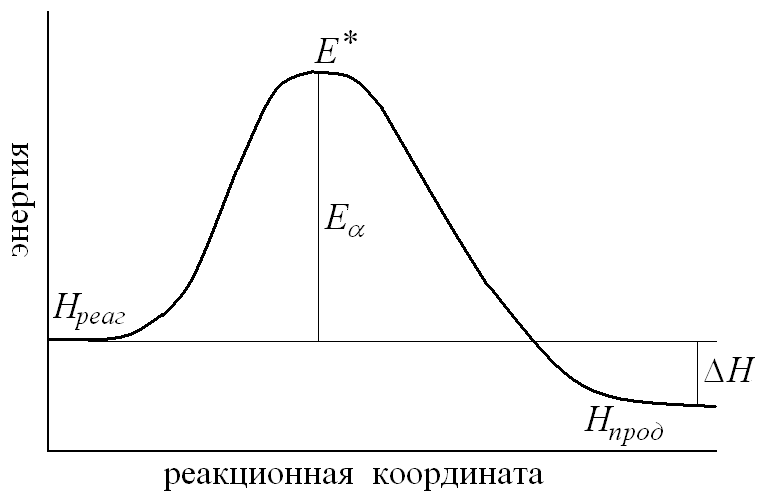
“Реакционная координата” характеризует продвижение системы по пути реакции.
Энергия “активированного комплекса” выше энергии исходных соединений на величину энергии активации.
Промежуточный комплекс, если не учитывать его крайне малую устойчивость, подобен обычным молекулам, атомы занимают в нем строго определенное положение, чем обеспечивается требуемая для реакции ориентация исходных молекул.
40) EA - энергия активации (пороговая энергия)
(если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры)
Для различных реакций энергия активации меняется примерно в пределах 40-300 кДж/моль.
