
Вопрос 8
Давлением жидкости называется физическая величина, определяемая нормальной силой, действующей со стороны жидкости на единицу площади:
P=dF/dS
Закон Паскаля:
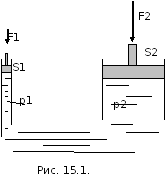
Давление при равновесии жидкостей или газов подчиняется закону Паскаля:
Давление в любом месте покоящейся жидкости одинаково по всем направлениям, причем давление одинаково передается по всему объему, занятому покоящейся жидкостью.
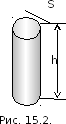
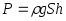 ,
,
а давление на нижнее основание изменяется линейно с высотой:

Давление ρgh называется гидростатическим.
Сила давления на нижние слои жидкости будет больше, чем на верхние, поэтому на тело, погруженное в жидкость действует сила, определяемая законом Архимеда.
Закон Архимеда: на тело, погруженное в жидкость или газ, действует со стороны этой жидкости (газа) направленная вверх выталкивающая сила, равная весу вытесненной телом жидкости (газа):
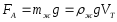
где: mж – масса вытесненной телом жидкости;
ρж – плотность жидкости,
VТ – объем тела, погруженного в жидкость.
Вопрос 10
Число Авогадро
Na=6.02*10^23
Газ наз идеальным если выполняются след условия
1 Собственный объём молекул газа намного меньше объёма сосуда в котором он заключён.
2 Кинетическая энергия движения молекул газа намного больше потенциальной т.е. отсутствуют взаимодействия молекул газа.
3 Изменения молекул газа между собой и со стенками сосуда являются абсолютно упругими.
В основе молекулярной физики лежит кинетическая теория вещества. (МКТ), которая основывается на след положениях.
1 Все вещества состоят из молекул.
2 Все молекулы находятся в непрерывном хаотическом движении.
Температура газа
1 имеет две реперные точки шкала цельсия-температура таяния льда и температура кипения воды
2 шкала кельвина имеет одну реперную точку-абсолютный ноль +273,17 град.
Законы идеальных газов
1) Закон Авогадро
1моль любого газа при нормальных условиях занимает одинаковый объём равный 22,4л
2) Закон Дальтона
Парциальным давлением наз давление одного газа в смеси, если бы он один занимал весь объём сосуда, в котором находится смесь газа.
Давление смеси газов равно сумме парциальных давлений всех газов входящих в смесь
Изопроцессы в газах
Процесс,протекающий при постоянной температуре наз изотермическим процессом.
Газовые законы
1) При пост температуре P1V1=P2V2
PV=const – Закон Бойля-Мориота – с уменьшением объёма давление растёт, а с увеличением, уменьшается.
2) При постоянном объёме давление газа увеличивается,чем больше давление тем больше объём.
P1/T1=P2/T2=P/T=const – Закон Гей-Люссака.
3) Если давление газа постоянно,то чем больше температура газа,то
V1/T1=V2/T2=V/T=const
Объединённый газовый закон
P1V1/T1=P2V2/T2=PV/T=const
Газовые законы справедливы в том случае,если масса газа не меняется. Если масса газа меняется, то необходимо использовать более общие уравнения Менделеева-Клайперрона.
PV=m/M*RT
R=8.31Дж/моль*К- универсальная газовая постоянная.
