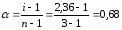- •Методические указания по химии к лабораторным работам и самостоятельной работе для студентов нехимических специальностей всех форм обучения и направления
- •Введение
- •Основные правила по технике безопасности при работе в химической лаборатории
- •Правила пожарной безопасности
- •Экспериментальная часть
- •3. Вопросы для самоконтроля
- •Лабораторная работа № 2 замерзание растворов
- •Теоретическая часть
- •2. Экспериментальная часть
- •Вопросы для самоконтроля
- •Лабораторная работа № 3 титриметрический метод анализа
- •Теоретическая часть
- •Техника приготовления растворов в мерных колбах из фиксаналов.
- •Порядок работы с бюреткой
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Приложение
- •Лабораторная работа № 4 адсорбция уксусной кислоты на поверхности активированного угля
- •Теоретическая часть
- •2.Экспериментальная часть
- •Вопросы для самоконтроля
- •Лабораторная работа № 5 коллоидные растворы
- •Теоретическая часть
- •Экспериментальная часть
- •Вопросы для самоконтроля
3. Вопросы для самоконтроля
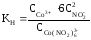
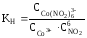
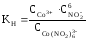
1. Какое выражение соответствует константе нестойкости комплексного иона в соединении Na3[Co(NO2)6]?
|
1)
|
4)
|
|
2)
|
5)
|
|
3)
|
|
2. В каком соединении степень окисления комплексообразователя наименьшая?
|
1) [Cu(NH3)4]SO4 |
2) [Ni(NH3)6]Cl2 |
3) [Hg(NH3)4](NO3)2 |
|
4) [Ag(NH3)2]Cl |
5) [Co(NH3)4]Cl2 |
|
3. Чему равно координационное число комплексообразователя в соединении [Co(NH3)2(H2O)4]Cl3?
|
1) 9 |
2) 6 |
3) 2 |
4) 4 |
5) 7 |
4. Указать формулу гексацианоферрат (II) калия.
|
1) K3[Fe(CN)6] |
2) K4[Ni(CN)6] |
3) K3[Co(CN)6] |
|
4) K2[Pt(CN)4] |
5) K4[Fe(CN)6] |
|
5. Сравнив константы нестойкости, указать самый нестойкий ион.
|
1)
|
2)
|
3)
|
|
4)
|
5)
|
|
Лабораторная работа № 2 замерзание растворов
Цель работы: определить температуру замерзания растворителя (воды), молярных растворов хлорида калия; вычислить степень диссоциации растворов хлорида калия и сравнить их между собой.
Теоретическая часть
Термодинамика процесса растворения.
Растворение веществ происходит с различными тепловыми эффектами.
Тепловой эффект сольватации - количество теплоты, которая выделяется при взаимодействии растворенного вещества с молекулами растворителя и образование связей между ними. Тепловой эффект, сопровождающий процесс растворения, относящийся к 1 молю растворенного вещества, называется молярной теплотой растворения ΔНраств.
ΔНраств. = ∆Н1 + ∆Н2
где ∆Н1 - количество теплоты, затраченной на распределение частиц растворяемого вещества среди молекул растворителя; или для твердого вещества, энергия необходимая для разрушения кристаллической решетки и энергия необходимая для разрыва связей между молекулами растворителя (процесс эндотермический).
∆Н2 - тепловой эффект сольватации (процесс экзотермический).
Сольватация - электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества ирастворителя. Сольватация в водных растворах называетсягидратацией.
В зависимости от того преобладает первая или вторая составляющие, процесс растворения может быть экзотермический или эндотермический:
если ∆Н2>∆Н1, процесс экзотермический и ∆Н < 0;
если ∆Н2 < ∆Н1, процесс эндотермический и ∆Н > 0.
Так, например, тепловой эффект растворения:
 раств.(NH4NO3)
= 26,5 кДж/моль,
раств.(NH4NO3)
= 26,5 кДж/моль,
 раств.(Н2SO4)
= −74,2 кДж/моль.
раств.(Н2SO4)
= −74,2 кДж/моль.
Коллигативные свойства растворов.
Свойства растворов, которые зависят только от концентрации частиц в растворе и не зависят от природы растворенного вещества, называются коллигативными.
Коллигативные свойства разбавленных растворов могут быть описаны количественно и выражены в виде законов. К ним относятся:
- давление насыщенного пара растворителя над раствором (закон Рауля)
- понижение температуры замерзания раствора
- повышение температуры кипения раствора
- осмотическое давление
1 закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
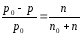
p0 - давление насыщенного пара над растворителем, Па p - давление насыщенного пара над раствором, Па n0 - число моль растворителя n - число моль растворенного вещества.
2 закон Рауля: понижение температуры замерзания и повышение температуры кипения раствора прямо пропорционально моляльной концентрации раствора (число моль растворенного вещества в 1 кг растворителя):
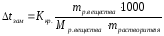
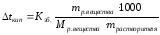
Ккр. – криоскопическая константа, Кэб. – эбулиоскопическая константа, выбираются для растворителя, кг·К/моль
mр. вещества – масса растворенного вещества, г
Мр. вещества – молярная масса растворенного вещества, г/моль.
mрастворителя – масса растворителя, г.
Осмос. Осмотическое давление, закон Вант-Гоффа.
Осмос - односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из раствора с низкой концентрацией в раствор с более высокой концентрацией.
Осмотическое давление росм. – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить явление осмоса:
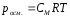
СМ – молярная концентрация раствора, моль/л
R = 8,31 Дж/моль·К, универсальная газовая постоянная
Т- температура, К.
Данные законы справедливы для идеальных растворов или растворов неэлектролитов, в растворах электролитов следует учесть диссоциацию молекул на ионы, т.к. для них не выполняются законы Рауля и Вант-Гоффа.
Для учета этих отклонений Вант-Гофф внес в уравнения поправку для растворов электролитов:
i – изотонический коэфициэнт.
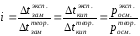
Изотонический коэффициэнт, как поправку вводят в уравнения свойств растворов. Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Степень диссоциации – отношение числа молекул, распавшихся на ионы, к общему числу молекул:
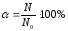
α – степень диссоциации
N – число молекул, распавшихся на ионы, N0 – общее число молекул
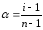
n – число ионов, на сколько диссоциирует молекула. Например для реакции:
CaCl2 → Ca2+ + 2Cl¯, n=3.
Примеры решения задач.
Вычислите понижение температуры замерзания раствора, если в 200 г бензола растворили 15 г гексана (C6H14), криоскопическая постоянная бензола - Ккр=5,07 К·кг/моль.
|
Дано: mрастворителя=200г (C6H6) mр. в-ва=15г (C6H14) Mр. в-ва =86г/моль (C6H14) Ккр=5,07 К·кг/моль(C6H6) Δt - ? |
Решение:
|
Аналогично решаются задачи на вычисление повышения температуры кипения и вычисления молярной массы растворенного вещества.
Вычислите осмотическое давление раствора при температуре 20ºC, если в 1 литре раствора содержится 50 г глюкозы (C6H12О6).
|
Дано: Vраствора=1л = 1·10-3 м3 mр. в-ва=50г (C6H12О6) Mр. в-ва =180г/моль (C6H12О6) t= 20ºC; 293 К R= 8,31 Дж/моль·К росм. -? |
Решение:
|
При растворении в 600 г воды 20 г хлорида кальция экспериментальное значение понижения температуры замерзания раствора составило 1,3оC, криоскопическая постоянная воды – Ккр=1,86 К·кг/моль. Вычислить степень диссоциации хлорида кальция.
|
Дано: mрастворителя=600г mр. в-ва=20г (CaCl2) Mр. в-ва =112г/моль (CaCl2) Ккр=1,86К·кг/моль(H2O) Δtзам. (экспер.)=1,3ºC α - ? |
Решение: Найдем теоретическое значение температуры замерзания раствора:
|
|
Изотонический коэффициент равен:
| |



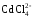
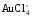
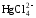
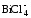

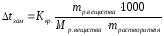
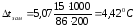
 ;
;
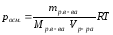
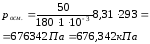
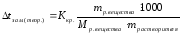
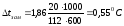
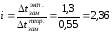 ;
n=3 (число ионов,
образующихся при диссоциации молекулы
хлорида кальция). Степень диссоциации
равна:
;
n=3 (число ионов,
образующихся при диссоциации молекулы
хлорида кальция). Степень диссоциации
равна: