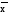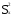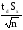- •Методические указания по химии к лабораторным работам и самостоятельной работе для студентов нехимических специальностей всех форм обучения и направления
- •Введение
- •Основные правила по технике безопасности при работе в химической лаборатории
- •Правила пожарной безопасности
- •Экспериментальная часть
- •3. Вопросы для самоконтроля
- •Лабораторная работа № 2 замерзание растворов
- •Теоретическая часть
- •2. Экспериментальная часть
- •Вопросы для самоконтроля
- •Лабораторная работа № 3 титриметрический метод анализа
- •Теоретическая часть
- •Техника приготовления растворов в мерных колбах из фиксаналов.
- •Порядок работы с бюреткой
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Приложение
- •Лабораторная работа № 4 адсорбция уксусной кислоты на поверхности активированного угля
- •Теоретическая часть
- •2.Экспериментальная часть
- •Вопросы для самоконтроля
- •Лабораторная работа № 5 коллоидные растворы
- •Теоретическая часть
- •Экспериментальная часть
- •Вопросы для самоконтроля
Экспериментальная часть
Получите у лаборанта колбу с раствором щёлочи неизвестной концентрации. Пробы анализируемого раствора отмерьте мерным цилиндром по 10 мл в три конические колбы для титрований. В каждую из них добавьте 2-3 капли индикатора метилового оранжевого. Раствор приобретёт жёлтую окраску (метилоранж жёлтый в щелочной среде и оранжево-красный в кислой).
|
|
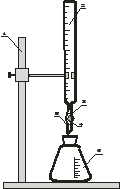
Рис.3 Установка для титрований:1 – штатив; 2 – бюретка; 3 – каучуковая трубка; 4 – стеклянный шарик (олива); 5 – стеклянный наконечник; 6 –коническая колба для титрования. |
Приготовьте к работе установку для титрований (рис.3) Бюретку ополосните дистиллированной водой, а затем заполните раствором серной кислоты точно известной концентрации (молярная концентрация эквивалента H2SO4 указана на склянке) выше нулевого деления. Каучуковую трубку со стеклянным наконечником отогните вверх и, оттягивая резину от стеклянной оливы, закрывающей выход из бюретки, медленно выпускайте жидкость так, чтобы после заполнения наконечника в нём не осталось пузырьков воздуха. Избыток раствора кислоты выпустите из бюретки в подставленный стакан, при этом нижний мениск жидкости в бюретке должен установиться на нулевом делении.
Одну из колб раствора щёлочи подставьте под наконечник бюретки на лист белой бумаги и приступайте непосредственно к титрованию: одной рукой медленно подавайте кислоту из бюретки, а другой непрерывно перемешивайте раствор круговым движением колбы в горизонтальной плоскости. В конце титрования раствор кислоты из бюретки следует подавать по каплям до тех пор, пока от одной капли раствор примет неисчезающую оранжевую окраску.
Определите объём кислоты, израсходованный на титрование, с точностью до 0,01мл. Отсчёт делений бюретки производите по нижнему мениску, при этом глаз должен находиться на уровне мениска.
Повторите титрование ещё 2 раза, начиная каждый раз с нулевого деления бюретки. Результаты титрований запишите в таблицу 1.
Концентрацию раствора щёлочи вычислите по формуле:
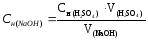
Таблица 1
Результаты титрования раствора гидроксида натрия
|
№ Определе-ния |
Объём пробы раствора щёлочи V(NaOH) , мл |
Объём раствора кислоты V(H2SO4), мл |
Молярная концентрация эквивалента щёлочи Сн(NaOH), моль/л
|
Среднее значение молярной концентрации эквивалента NaOH в анализируемом растворе, моль/л | ||
|
1 |
|
|
|
| ||
|
2 |
|
|
| |||
|
3 |
|
|
| |||
Проведите статистическую обработку результатов титрований по методике, описанной в приложении. Результаты статистической обработки экспериментальных данных сведите в таблицу 2.
Таблица 2
Результаты статистической обработки экспериментальных данных титрования раствора гидроксида натрия. Доверительная вероятность α = 0,95.
|
n |
|
|
Sx |
|
|
|
|
|
|
|
Запишите результат определения молярной концентрации эквивалента NaOH в анализируемом растворе в виде доверительного интервала.