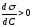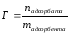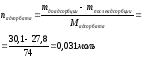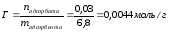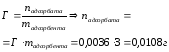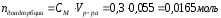- •Методические указания по химии к лабораторным работам и самостоятельной работе для студентов нехимических специальностей всех форм обучения и направления
- •Введение
- •Основные правила по технике безопасности при работе в химической лаборатории
- •Правила пожарной безопасности
- •Экспериментальная часть
- •3. Вопросы для самоконтроля
- •Лабораторная работа № 2 замерзание растворов
- •Теоретическая часть
- •2. Экспериментальная часть
- •Вопросы для самоконтроля
- •Лабораторная работа № 3 титриметрический метод анализа
- •Теоретическая часть
- •Техника приготовления растворов в мерных колбах из фиксаналов.
- •Порядок работы с бюреткой
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Приложение
- •Лабораторная работа № 4 адсорбция уксусной кислоты на поверхности активированного угля
- •Теоретическая часть
- •2.Экспериментальная часть
- •Вопросы для самоконтроля
- •Лабораторная работа № 5 коллоидные растворы
- •Теоретическая часть
- •Экспериментальная часть
- •Вопросы для самоконтроля
Лабораторная работа № 4 адсорбция уксусной кислоты на поверхности активированного угля
Цель работы: изучение адсорбции уксусной кислоты на активированном угле, определение величины адсорбции уксусной кислоты.
Теоретическая часть
Сорбция (от лат. sorbeo — поглощаю) - поглощение твёрдым телом либо жидкостью различных веществ из окружающей среды.
Адсорбция (от лат. ad-на, при и sorbeo-поглощаю) - поглощение на поверхности, рассматривается как изменение концентрации растворенного вещества на границе раздела фаз (газ - твердое тело, жидкость - твердое тело, газ – жидкость).
Абсорбция – процесс поглощения растворенного вещества, сопровождающийся диффузией растворенного вещества вглубь сорбента, на практике используется поглощение газов жидкостями, например, для очистки природного газа от воды, сероводорода, оксида углерода (IV) используются растворы спиртов, этаноламинов.
Сорбент, адсорбентом, абсорбент - вещество которое поглощает.
Наиболее распространены твердые адсорбенты – активированный уголь, кварц, селикагели, цеолиты и т.д.
Сорбтив, адсорбтив, абсорбтив – вещество которое будет поглощаться.
Сорбат, адсорбат, абсорбат – поглощенное вещество.
Десорбция – процесс обратный сорбции
Хемосорбция – процесс поглощение сопровождающийся химическими реакциями. Является необратимым процессом.
В лабораторной работе рассматривается процесс адсорбции. Величиной адсорбции Г – называют отношение числа молей поглощенного вещества к площади адсорбента или отношение числа молей поглощенного вещества к массе адсорбента:
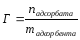 ,
,
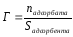
Единицы измерения величины адсорбции – моль/г, моль/м2
Величина адсорбции Г зависит от природы адсорбента (полярный или неполярный адсорбент и т.д.), адсорбтива (неорганические ионы, ПАВ и др.) и его концентрации, температуры и давления. Так при постоянной температуре физическая адсорбция увеличивается с ростом давления газа или концентрации раствора.
Природа адсорбционных сил может быть различной. Если это ван-дер-ваальсовы силы взаимодействия, то адсорбция называется физической; если адсорбция сопровождается образованием на поверхности химических соединений – то химической адсорбцией.
Адсорбция является самопроизвольным и экзотермическим процессом для которого термодинамические параметры - ΔG<0, ΔН < 0.
С увеличением температуры физическая адсорбция уменьшается. С увеличением давления увеличивается адсорбция газообразных веществ.
График зависимость величины адсорбции Г от концентрации раствора адсорбируемого вещества называется изотермой адсорбции Ленгмюра и имеет зависимость представленную на рис.1. Уравнение Ленгмюра имеет вид:
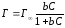
Г – адсорбция, моль/м2; Г∞ – предельная адсорбция, моль/м2; С – равновесная концентрация вещества, моль/л; b – константа адсорбционного равновесия, зависит от температуры и природы адсорбента.

Количественное соотношение между величиной адсорбции Г и изменением поверхностного натяжения определяется уравнением Гиббса:

Г – адсорбция, моль/м2; С – равновесная концентрация растворенного вещества, моль/л; R (универсальная газовая постоянная) = 8,314 Дж/моль∙К; Т – температура, К; Δσ (изменение поверхностного натяжения) = σр-ра-σр-ля, Дж/м2
ΔC (изменение концентрации) = Ср-ра – Ср-ля, моль/л.
Отношение
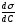 называют поверхностной активностью.
называют поверхностной активностью.
Адсорбция
положительна, когда
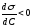 ,
т.е. когда при протекании адсорбции
поверхностное натяжение понижается.
,
т.е. когда при протекании адсорбции
поверхностное натяжение понижается.
Закон Генри: Величина адсорбции пропорциональна концентрации адсорбтива в растворе. Коэффициент пропорциональности k - коэффициент Генри - является мерой интенсивности адсорбции.
Г = k·p, или Г=k·C
р – давление, Па; С – равновесная концентрация растворенного вещества, моль/л
Поверхностно активные вещества (ПАВ).
ПАВ - химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения. К ПАВ относятся органические соединения, содержащие в своем составе атом кислорода, серы, азота, т.е. наличие этих атомов приводит к образованию полярной группы так как они характеризуются большим значением электроотрицательности и способны смещать к себе общую электронную плотность. Молекулы ПАВ называют дифильными молекулами (имеющие сродство к веществам разной природы).
Строение молекулы ПАВ:
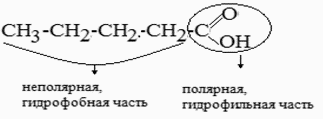
Схематично молекулы ПАВ зарисовывают в виде:

ПАВ делятся на катионные и анионные (ионогенные) ПАВ – способные диссоциировать в водном растворе на катионы и анионы; и на неионогенные ПАВ, не подвергающиеся диссоциации.
Например, соли карбоновых кислот являются анионными ПАВ:
RCOONa → RCOO¯ + Na+
Поверхностно инактивные вещества ПИВ, при их растворении повышают поверхностное натяжение, к ним относятся неорганические соединения (соли, кислоты), диссоциирующие на ионы.
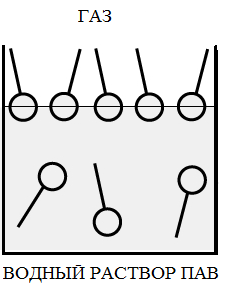
При адсорбции ПАВ на границе раздела фаз газ - жидкость, они ориентируются полярной группой в сторону полярного растворителя, пример на рис. 2а, где показана ориентация молекул ПАВ на границе газ –вода (молекулы воды – полярные молекулы).
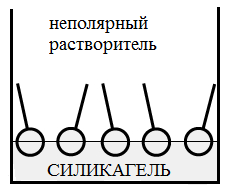
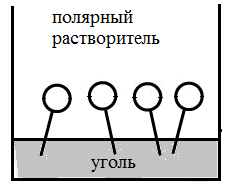
На границе раздела фаз жидкость – твердое тело, молекулы ПАВ ориентируются, адсорбируясь на твердых адсорбентах полярной группой в сторону полярного адсорбента, но при этом следует учитывать и полярность растворителя.
На рис. 2 б,в представлена адсорбция ПАВ на силикагеле (полярном адсорбенте) и угле (неполярном адсорбенте).
|
|
|
|
|
а |
б |
в |
Рис 2. а – адсорбция ПАВ на границе газ-жидкость, б,в – адсорбция ПАВ на границе твердое тело – жидкость.
При адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется правило Дюкло - Траубе:
В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяженияводного раствора до определённого уровня, снижается в 3-3,5 раза при увеличении углеродного радикала на одну -СΗ2-группу.
В таблице 1 показана зависимость поверхностного натяжения и величины адсорбции от того, относиться растворенное вещество к ПАВ или ПИВ.
Таблица 1.
Зависимость поверхностного натяжения, величины адсорбции от типа растворенного вещества.
|
Растворенное вещество |
Поверхностное натяжение |
Поверхностная активность |
Величина адсорбции |
|
ПАВ |
↓ |
|
Г↑ |
|
ПИВ |
↑ |
|
Г↓ |
Примеры решения задач.
Масса изобутилового спирта до адсорбции составила 30,1 г, после адсорбции -27,8 г. Масса адсорбента – 6,8 г. Рассчитайте величину адсорбции (моль/г).
|
Дано: mдо адсорбции = 30,1г (С4Н10О) mпосле адсорбции = 27,8г (С4Н10О) mадсорбента = 6,8г Гадсорбции - ? |
Решение:
|
Найдите молярную концентрацию метилового спирта после адсорбции на активированном угле массой 3,0 г, если величина адсорбции составила 0,0036 моль/г. Для определения было взято 55 мл раствора с концентрацией 0,3 моль/л.
|
Дано: mадсорбента = 3г Гадсорбции = 0,0036 моль/г Vр-ра= 55мл = 0,055л СМ= 0,3 моль/л mпосле адсорбции -? |
Решение:
|