
Соединения Ti, Zr, Hf (IV)
Анионные приозводные
Получение:
Спекание, плавление MO2 с оксидами или карбонатами металлов:
Na2CO3 + MO2 Na2MO3 + CO2
CaO + MO2 CaMO3
Строение:
Решетка перовскита CaTiO3 кубическая. Октаэдры TiO6/2, все атомы кислорода мостиковые. Пространство между октаэдрами занимает Ca.
Физические свойства:
Твердые тугоплавкие вещества.
Химические свойства:
-
Гидролиз водой и кислотами:
Na2TiO3 + H2O Ti(OH)4 + NaOH
CaZrO3 + H2SO4 CaSO4 + ZrOSO4 + H2O
Применение:
BaTiO3, PbTiO3 и PbZrO3 – сегнетоэлектрики
Другие – пьезоэлектрики
Сегнетоэлектрик – самопроизвольно поляризуется в электрическом поле, изменяя электрофизические, омические и теплофизические свойства.
Пьезоэлектрики – появляется электрическое поле при действии нагрузки.
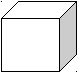








Перовскит
CaTiO3 CaTi8/8O6/2
Ca в центре куба, Ti – в вершинах куба,
O – в центрах граней куба
Соединения Ti, Zr, Hf (IV) Галогениды
Получение:
-
Из простых веществ
M + 2X2 MX4
-
Обменные реакции
TiCl4 + HF TiF4 + HCl (безв.HF)
TiCl4 + HI TiI4 + HCl (безв. HI)
TiO2 + AlI3 TiI4 + Al2O3
TiO2 + CCl4 TiCl4 + CO2 (COCl2)
-
Хлорирование и бромирование в присутствии угля
TiO2 + C + Cl2 TiCl4 + CO (800˚С)
TiO2 + C + Br2 TiBr4 + CO (800˚С)
Физические свойства:
Твердые (кроме TiCl4), нелетучие при повышенной температуре вещества.
Строение:
TiCl4,TiBr4, TiI4 – правильные тетраэдры, TiF4 – ионное соединение.
(Zr, Hf) F4 – построены из антипризм.
ZrF8/4 – все атомы F мостиковые.
Химические свойства:
-
Термически устойчивые вещества. Менее других устойчивы иодиды:
MI4 M + 2I2
-
Обменные реакции, гидролиз, компексообразование
TiCl4 + HF TiF4 + HCl
TiF4 + 2HF H2TiF6
TiCl4 + 2H2O Ti(OH)2Cl2 + 2HCl
Ti(OH)2Cl2 TiOCl2 + H2O
TiOCl2 + H2O Ti(OH)4 + HCl
TiCl4 + H2S TiS2 + HCl (800˚С)
-
Восстановение
МХ4 + 2Мg M + 2MgX2
МХ4 +4Na M + 4NaX
TiCl4 + Ti TiCl3
TiCl4 + H2 TiCl3 + HCl (600˚С)
-
K2[ZrF6] + K2[HfF6] отделяют дробной кристаллизацией
-
ZrCl4 + HfCl4 отделяют ректификацией или сублимацией.
Применение:
-
Получение чистых M и MO2.
-
Синтез других соединений M.
-
Создание дымовых завес.
-
TiCl4 – катализатор полимеризации этилена.
Соединения Ti, Zr, Hf с анионами кислородосодержащих кислот
Получение:
-
T
р-р SO3 в SO2Cl2
iCl4 + SO3 Ti(SO4)2 +SO2Cl2
T
-60˚С
TiCl4 + N2O4 Ti(NO3)4 +NOCl
Аналогично для Hf и Zr.
-
Соединения MO2+ получают гидролизом безводных производных или действием кислот на MO2 и др.
TiO2 + H2SO4(конц, медленно) TiOSO4 + H2O
TiO2 + K2S2O7(конц) TiOSO4 + K2SO4
Z
фактически
H2[ZrO(SO4)2]
• 3H2O
Аналогично с HNO3 H2[ZrO(NO3)4] • 4H2O
Действие H2O или H2SO4 и HNO3 средних концентраций MO2+
Ti(SO4)2 + H2O H2SO4 + TiOSO4 TiOSO4• 2H2O
ZrO2 + H2SO4 ZrOSO4 + H2O
-
Осаждением из водных растворов получают Zr(HPO4)2 и Zr(IO3)4, нерастворимые в сильных кислотах, но растворимые в HF H2ZrF6
Физические свойства:
Твердые, белые, гидроскопичные.
Строение:
TiOSO4 – атомы кислорода мостиковые, сульфат-ионы полидентатны, что позволяет образовывать TiO8 антипризмы.
Химические свойства:
-
Гидролиз M(SO4)2 MOSO4 M(OH)4
-
Восстановление в водных растворах (для Ti)
TiOSO4 + Zn + H2SO4 Ti2(SO4)3 + ZnSO4 + H2O
TiOSO4 + Fe + H2SO4 Ti2(SO4)3 + FeSO4 + H2O
-
Комплексообразование
Ti(SO4)2 + K2SO4 K2[Ti(SO4)3]
T
кач. реакция
оранжевый
-
Термораспад
M(SO4)2 MO2 + SO3
MOSO4
Применение:
-
K2[Zr(SO4)3] + K2[Hf(SO4)3] – отделение Hf от Zr дробной крмсталлизацией.
-
(Zr, Hf) (IO3)4↓ - отделяют от РЗЭ при переработке руд.
