- •Лекция 12 от 7 декабря 2007 г. Гемостаз
- •1. Понятия «гемостаз», «система регуляции агрегатного состояния крови»
- •Понятие «система регуляции агрегатного состояния крови (раск)»
- •Гемостатический потенциал
- •2. Сосудисто-тромбоцитарный гемостаз
- •Клинические проявления дефицита факторов сосудисто-тромбоцитарного гемостаза
- •3. Методы исследования сосудисто-тромбоцитарного гемостаза
- •Резистентность (ломкость) капилляров Проба Румпель-Лееде-Кончаловского
- •Время кровотечения
- •Метод Дьюка
- •Метод Айви
- •Подсчет числа тромбоцитов
- •Подсчет в камере Горяева
- •Метод подсчета тромбоцитов в окрашенных мазках крови
- •Автоматический метод подсчета тромбоцитов
- •Ретракция сгустка крови
- •Определение ретенции (адгезивности) тромбоцитов
- •Исследование агрегации тромбоцитов
- •4. Коагуляционный гемостаз: теория а.А.Шмидта–п.Моравитца
- •Теория Шмидта–Моравитца
- •5. Плазменные факторы свёртывания крови
- •Общая характеристика плазменных факторов свёртывание крови
- •Характеристика отдельных плазменных факторов свёртывания крови Фактор I (фибриноген)
- •Фактор II (протромбин)
- •Фактор III (тканевый тромбопластин)a
- •Фактор IV (ионизированный кальций)
- •Фактор V (проакцелерин)
- •Фактор VII (проконвертин)
- •Фактор VIII (антигемофильный глобулин а)
- •Фактор IX (антигемофильный глобулин b или Кристмас-фактор)
- •Фактор X (Стюарта—Прауэра)
- •Фактор XI (плазменный предшественник тромбопластина)
- •Фактор XII (контактный фактор Хагемана)
- •Фактор XIII (фибринстабилизирующий, фибриназа, фактор Лаки-Лоранда)
- •Фактор Флетчера (плазменный прекалликреин)
- •Фактор Фитцжеральда-Фложе — высокомолекулярный кининоген плазмы
- •Образование тромбина (фаза II, общий путь)
- •Образование фибринового тромба (фаза III)
- •Посткоагуляционная фаза
- •Связь внешнего и внутреннего механизмов свертывания крови
- •Феномен паракоагуляции
- •8. Методы исследования гемокоагуляции Общие вопросы
- •Время свертывания крови Метод Моравитца
- •Определение времени свертывания крови (унифицированный двупробирочный метод Ли —Уайта).
- •Определение времени рекальцификации плазмы (унифицированный метод).
- •Активированное частичное (парциальное) тромбопластиновое время (ачтв)
- •Определение толерантности плазмы к гепарину (унифицированный метод Горстмена).
- •Определение протромбинового времени (унифицированный метод Квика).
- •Тромбоэластограмма.
- •Определение времени свертывания цельной нестабилизированной крови
- •Тромбоэластография
- •9. Противосвертывающая система крови
- •Первичные антикоагулянты
- •Вторичные антикоагулянты
- •10. Фибринолиз
- •Плазминовый вариант фибринолиза:
- •Неплазминовый вариант фибринолиза
- •11. Нейрогуморальная регуляция агрегатного состояния крови
- •Добавить Фибринтаймер bf-II
- •Тромбиновое время 712080905
Характеристика отдельных плазменных факторов свёртывания крови Фактор I (фибриноген)
Стабильный белок-глобулин;
Молекулярная масса — 341 000 дальтон; длина молекулы 46 нм
Место синтеза — печень;
Содержание в плазме — 1.8—4.0 г/л;
Период полужизни в плазме после внутривенного введения — 4—5 дней;
Минимальный уровень, необходимый для гемостаза — 0.8 г/л;
Хромосома, кодирующая синтез — 4q23-q32.
Фибриноген является плазменным глобулином,
Молекула состоит из шести полипептидных цепей (две Аα-цепи, две Вβ-цепи и две γ-цепи). Структура фибриногена — Аα2Вβ2γ2 (рис. 712071610).
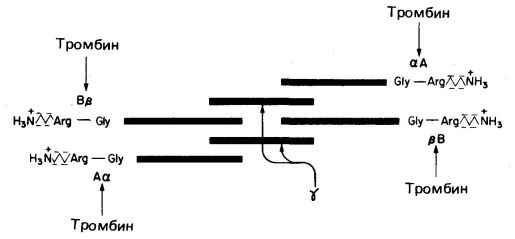
Рис. 712071610. Схематическое изображение фибриногена, его структуры (АαВβγ)2, заряженных концов, сайтов расщепления тромбином (стрелки) четырех пептидных связей Arg-Gly.
Вβ- и γ-цепи содержат сложные олигосахариды, связанные с остатками аспарагина (Asn). Концы молекул фибриногена обладают сильным отрицательным зарядом; это обусловлено присутствием большого количества остатков аспартата и глутамата в А-области цепи Аα и в В-области области цепи Вβ (рис. 712071610). Помимо этого В-область цепи Вβ содержит необычно отрицательно заряженный остаток тирозин-О-сульфата. Отрицательно заряженные концы молекул фибриногена не только способствуют растворимости последних в воде, они отталкивают концы других молекул фибриногена, что предотвращает агрегацию последних.
Под действием тромбина (фактор IIa), расщепляющего пептидные связи Apr—Гли, от фибриногена отщепляются четыре низкомолекулярных пептида, и он превращается в фибрин-мономер (Im), способный к аутополимеризации за счет свободных связей.
Фактор II (протромбин)
Сериновая протеаза. Гликопротеин, по электрофоретической подвижности относится к 2-глобулинам; молекулярная масса — 68 000—72 000 дальтон; синтезируется в печени при участии витамина К; содержание в плазме крови — около 0.1 г/л (100 мкг/л) или 80-120% активности; период полужизни в плазме после внутривенного введения — 67—106 ч; минимальный уровень, необходимый для гемостаза — 20—40%; хромосома, кодирующая синтез — 11.
Протромбин является стабильным протеином, имеет специфическую особенность — связывать кальций (одна молекула протромбина связывает 10—12 ионов Са2+), при этом происходят конформационные изменения структуры белка протромбина. Протромбин превращается в тромбин под влиянием комплекса протромбиназы.
Под действием протромбиназы от него отщепляются -, - и -тромбины (фактор IIа): -тромбин очень активен, но быстро нейтрализуется антитромбином III; -тромбин менее активен, но устойчив к действию гепарина и антитромбина III; -тромбин не имеет свертывающей активности, но обладает фиб- ринолитическим действием.
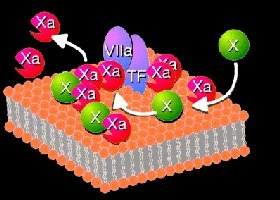
Фактор III (тканевый тромбопластин)a
Это комплекс липопротеиновой природы с очень высокой молекулярной массой до 167 000 000 дальтон. Он содержится в различных тканях — легких, головном мозге, печени, плаценте, почках, эндотелии сосудов (в эндотелиальных клетках в небольшом количестве) и выделяется в кровь при повреждении тканей.
В присутствии ионов кальция активирует фактор VII и участвует в трансформации протромбина в тромбин.
Апопротеин III в комплексе с фосфолипидами;
входит в состав мембран клеток многих тканей; эритроциты, лейкоциты и тромбоциты содержат только лицидный комплекс — при контакте с фактором VIIa и IV способен активировать фактор X (по быстрому пути). Он является матрицей для развертывания реакций образования протромбиназы, что обеспечивает высокую локальную концентрацию факторов свертывания;