
- •2.1.Углеводороды.
- •2.1.1.Алканы.
- •2.1.2.Циклоалканы.
- •Номенклатура
- •2.1.3.Алкены
- •2.1.4.Алкины
- •2.1.5.Алкадиены
- •2.1.6.Арены
- •2.2.Гидроксисоединения.
- •2.2.1.Одноатомные спирты.
- •2.2.2.Фенолы.
- •2.2.3.Простые эфиры.
- •Приведенное выше расщепление диметилового эфира представляет собой sn2 реакцию. Однако другие простые эфиры могут расщепляться и по механизму sn1. I
- •2.2.6.Двухатомные фенолы.
- •2.3.Оксосоединения.
- •Номенклатура карбонильных соединений.
- •2.4.Карбоновые кислоты
- •2.4.1.Особенности дикарбоновых кислот.
- •2.5.Функциональные производные карбоновых кислот.
- •2.6.Амины.
2.6.Амины.
Аминами называют производные углеводородов, в которых атом водорода замещен на группыNH2 , - NHR1 . -NHR1R2, например:R-NH2, R-NHR1, R-N-R1 R2. С другой стороны, амины можно рассматривать как производные аммиака, в котором один или несколько атомов водорода замещены на органические радикалы. В зависимости от числа атомов водорода, замещенных в аммиаке, различают первичные, вторичные и третичные амины, при этом не имеет значения, какие радикалы (первичные, вторичные или третичные) являются заместителями. В зависимости от природы органического радикала амины могут относиться к алифатическому, ароматическому, гетероциклическому ряду или быть смешанными.
Номенклатура аминов.
 По
ИЮПАК первичные амины называют, добавляя
окончание “амин “ к названию наиболее
длинной углеродной цепи, например:
По
ИЮПАК первичные амины называют, добавляя
окончание “амин “ к названию наиболее
длинной углеродной цепи, например:
метанамин этанамин пропанамин-2
Вторичные и третичные амины рассматривают как N-замещенные производные алканаминов, например:
![]() N-
этилэтанамин
N-
этилэтанамин
Широко распространена и другая номенклатура. Названия аминов образуются от названия алкильных групп, связанных с атомом азота, с добавлением слова «амин», при этом радикалы перечисляют в порядке возрастания сложности:
м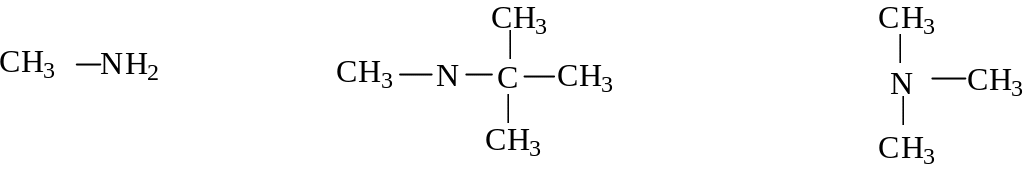 етиламин
метил-трет.- бутиламин триметиламин
етиламин
метил-трет.- бутиламин триметиламин
(первичный амин) (вторичный амин) (третичный амин)
Еще одним типом соединений, встречающимся в этом ряду, являются четвертичные аммонийные соли ( R4 N + X - ). Названия последних строится по аналогии с названиями солей аммония неорганических кислот, например:
(CH3) 4 N + HSO4 - гидросульфат тетраметиламмония.
Аналогичным образом называют ариламины, хотя чаще всего их рассматривают как производные анилина. Например:
А![]() нилин
N-метиланилин
нилин
N-метиланилин
Физические свойства аминов.
Низшие амины - газы, средние - жидкости, высшие - твердые вещества. С увеличением молекулярной массы аминов увеличивается их плотность, повышается температура кипения и уменьшается растворимость в воде. Низшие амины имеют неприятный запах, несколько напоминающий запах аммиака. Ароматические амины пахнут не столь неприятно, как алкиламины, но они,как приавило, токсичны. Некоторые амины являются мощными канцерогенами, например, бензидин, α-нафтиламин.
 Бензидин
α - нафтиламин
Бензидин
α - нафтиламин
Первичные и вторичные амины способны образовывать межмолекулярные водородные связи, поэтому они имеют более высокие температуры кипения, чем неполярные соединения с той же молекулярной массой. Поскольку третичные амины не могут образовывать водородных связей, их температуры кипения ближе к температурам кипения соответствующих неполярных соединений. Низкомолекулярные амины смешиваются с водой в любых соотношениях из-за возможности образования водородных связей с молекулами воды.
Стереохимия аминов.
Атом азота в алифатических аминах имеет пиримидальное строение. Третичные амины с тремя различными заместителями у атома азота хиральны, однако,вследствие легкой инверсии (обращение конфигурации) энантиомеры у аминов в настоящее время не выделены.

Конфигурация атома азота не может обращаться, если свободная пара электронов участвует в образовании координационной ковалентной связи, поэтому катион метилаллилфенилбензиламмония конфигурационно устойчив и может разделяться на энантиомеры:
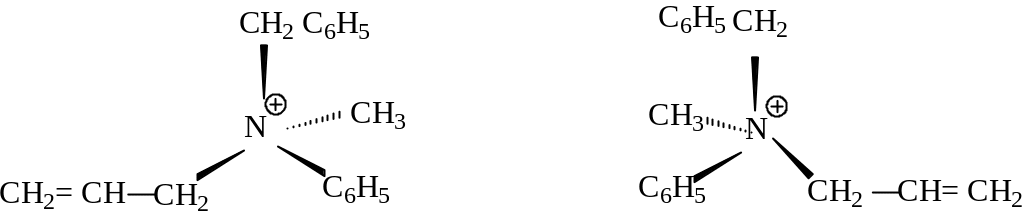
энантиомеры
Химические свойства аминов.
Наличие свободной электронной пары у атома азота обусловливает основные свойства аминов. Амины являются органическими основаниями.
Основные свойства аминов. При растворении амина в воде образуется катион RNH3+, таким образом, в водном растворе образуется избыток гидроксид-ионов, что обусловливает основные свойства, достаточные для окрашивания растворов лакмуса в синий цвет, а фенолфталеина - в малиновый. Основность аминов алифатического ряда колеблется в очень небольших пределах и близка к основности аммиака. На основность аминов влияют электронные эффекты заместителей. +I эффект заместителей повышает основность аминов, заместители с -I эффектом - понижают основность. Замена атомов водорода аммиака на алкильные группы увеличивает основность аминов. Это согласуется с электронодонорными свойствами алкильных групп, стабилизирующих сопряженную кислоту амина (R3NH+) и тем самым повышающих их основность. Однако триэтиламин обладает несколько меньшей основностью, чем диэтиламин. Полагают, что это вызвано эффектом “сольватации”. Другими словами, за счет того, что пространство вокруг азота экранировано алкильными заместителями, стабилизация на нем положительного заряда молекулами растворителя затруднена. Если действительно уменьшение основности при переходе от третичного амина ко вторичному вызвано влиянием растворителя, то при измерении основности в газовой фазе порядок основности должен быть другим, что и подтверждается экспериментом. В газовой фазе триалкиламин обладает наивысшей основностью.
п![]() орядок
основности аминов в газовой фазе
орядок
основности аминов в газовой фазе
Ариламины отличаются меньшей основностью по сравнению с аммиаком и алкиламинами,так как за счет индуктивного и мезомерного эффектов ароматической группы электронная плотность на атоме азота в случае ариламинов уменьшена. Амины как основания образуют соли с кислотами:
А![]() мины
в реакциях выступают как нуклеофилы.
Это в первую очередь реакции алкилирования
и ацилирования. Алкилирование.При
взаимодействии аминов с алкилгалогенидами
происходит замещение атомов водорода
на алкильные радикалы. Так, при
взаимодействии с первичным амином
образуется вторичный амин,затем вторичный
амин может превратиться в третичный и,
наконец, в соль тетраалкилзамещенного
аммония. Например:
мины
в реакциях выступают как нуклеофилы.
Это в первую очередь реакции алкилирования
и ацилирования. Алкилирование.При
взаимодействии аминов с алкилгалогенидами
происходит замещение атомов водорода
на алкильные радикалы. Так, при
взаимодействии с первичным амином
образуется вторичный амин,затем вторичный
амин может превратиться в третичный и,
наконец, в соль тетраалкилзамещенного
аммония. Например:
В![]() торичный
амин
торичный
амин
Т![]() ретичный
амин
ретичный
амин
с![]() оль
тетраалкиламмония
оль
тетраалкиламмония
Реакция алкилирования, именно метилирования, широко используется в организме. Так осуществляется превращение коламина (этаноламина) в холин, норадреналина в адреналин. Метилирование аминогруппы в организме является одним из способов биотрансформации лекарственных средств.
Другая очень важная реакция аминов - это реакция ацилирования. Ацилированием аминов называют реакцию замещения водорода аминогруппы на ацильный радикал - остаток кислородсодержащей минеральной, карбоновой, сульфокислоты. Реакция ацилирования используется для защиты аминогруппы, например, при синтезе пептидной связи. Ацилирование применяют для получения важных промежуточных лекарственных средств. Введение ацильной группы в лекарственное вещество имеет своей целью уменьшение его токсичности. При обсуждении карбоновых кислот и их производных отмечалось, что при взаимодействии аммиака с хлорангидридами кислот образуются амиды. Этот же процесс протекает при взаимодействии с первичными и вторичными аминами.
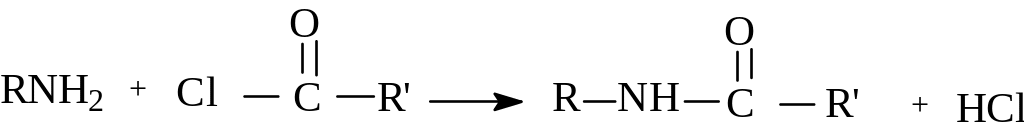
Ацилирование аминов осуществляется путем нуклеофильной атаки по карбонильной группе, содержащей хорошую уходящую группу ( галогенид-ион ):
Р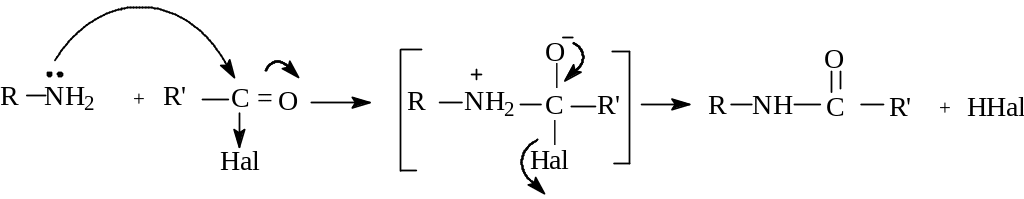 еакция
аминов с азотистой кислотой.
Эта реакция имеет аналитическое значение,
так как позволяет различать первичные,
вторичные и третичные амины неароматического
характера. При действии азотистой
кислоты на первичные алифатические
амины выделяется свободный азот и
образуется спирт:
еакция
аминов с азотистой кислотой.
Эта реакция имеет аналитическое значение,
так как позволяет различать первичные,
вторичные и третичные амины неароматического
характера. При действии азотистой
кислоты на первичные алифатические
амины выделяется свободный азот и
образуется спирт:

Вторичные амины при взаимодействии с азотистой кислотой образуют нитрозоамины - желтоватые жидкости, мало растворимые в воде:
(![]() нитрозодиметиламин
нитрозодиметиламин
Третичные амины устойчивы к действию азотистой кислоты.
Взаимодействие аминов с карбонильными соединениями.
При рассмотрении химии карбонильных соединений уже отмечалось, что при реакции альдегидов и кетонов с аммиаком образуются имины. Первичные и вторичные амины взаимодействуют с карбонильными соединениями, давая карбиноламины, которые подвергаются дегидратации до иминов (оснований Шиффа). Основания Шиффа играют важную роль в ряде биохимических процессов, например,в цикле Кребса и в реакциях переаминирования. Общая схема реакции:
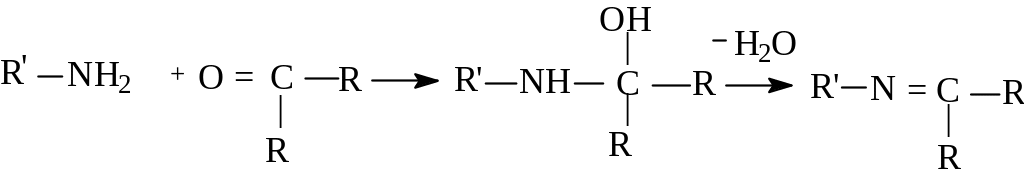 карбиноламин
кетимин
карбиноламин
кетимин
Ароматические амины.
Ароматические амины содержат аминогруппу, непосредственно связанную с бензольным ядром. Простейшим ароматическим амином является аминобензол, называемый анилином. Ароматические амины в отличие от алифатических аминов представляют собой слабые основания. Водный раствор ароматических аминов не изменяет окраску лакмуса и фенолфталеина, хотя с сильными кислотами образуют соли. Так, при взаимодействии анилина с соляной кислотой получается солянокислый анилин:
П![]() онижение
основных свойств анилина по сравнению
с алифатическими аминами обусловлено
сопряжением неподеленной пары электронов
атома азота с бензольным ядром.
онижение
основных свойств анилина по сравнению
с алифатическими аминами обусловлено
сопряжением неподеленной пары электронов
атома азота с бензольным ядром.
А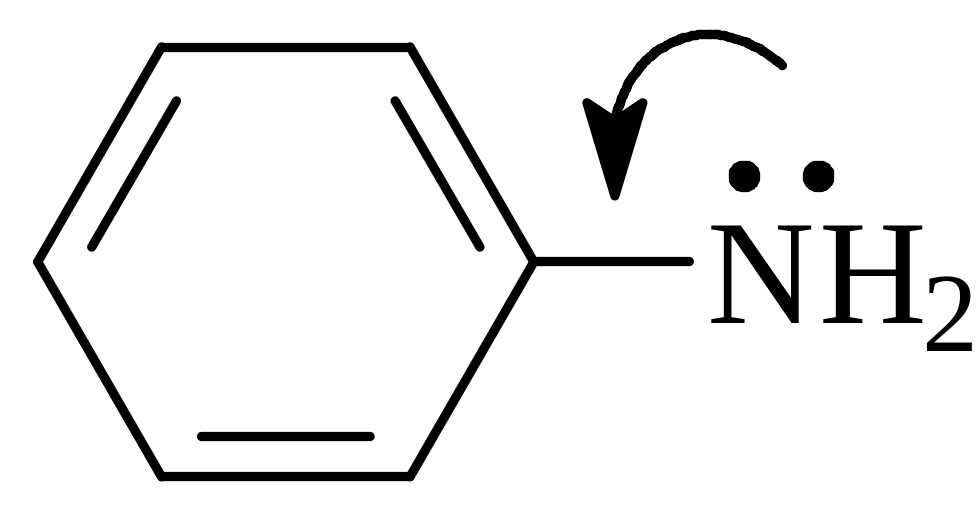 нилин,
как и амины жирного ряда, вступает в
реакции алкилирования, ацилирования,
например:
нилин,
как и амины жирного ряда, вступает в
реакции алкилирования, ацилирования,
например:
метилирование:
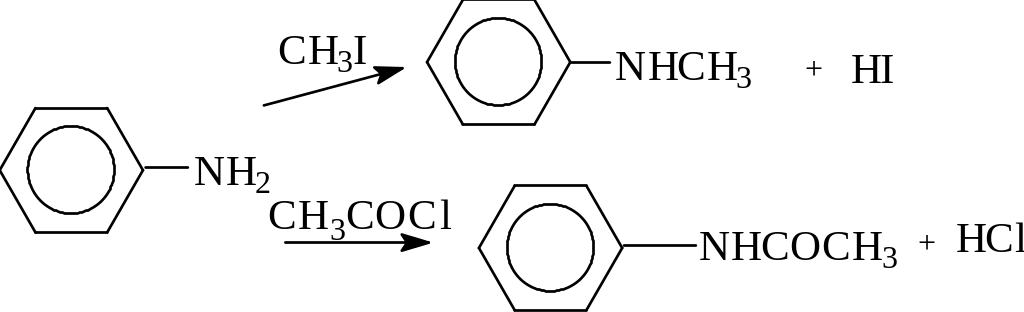 ацетилирование:
ацетилирование:
Соли диазония
При действии азотистой кислоты в кислых растворах на холоду анилин и другие ароматические первичные амины образуют так
н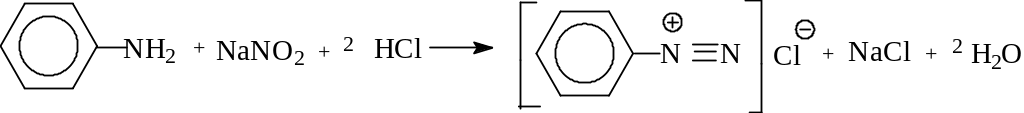 азываемые
соли диазония:
азываемые
соли диазония:
Свойства солей диазония.
С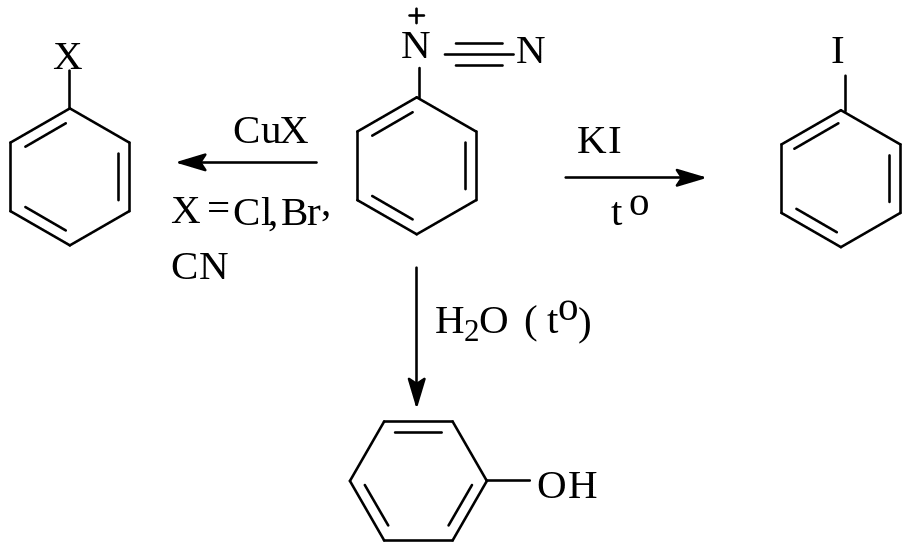 оли
диазония широко используются в
органическом синтезе, с их помощью можно
вводить в ароматическое ядро различные
функциональные группы, получать фенолы
и галогенпроизводные, нитрилы.
оли
диазония широко используются в
органическом синтезе, с их помощью можно
вводить в ароматическое ядро различные
функциональные группы, получать фенолы
и галогенпроизводные, нитрилы.
Соли диазония являются по своей природе электрофильными агентами, но слабыми из-за возможности делокализации положительного заряда с участием бензольного ядра, вследствие чего они взаимодействуют только с ароматическими соединениями, активированными сильными электронодонорными заместителями, какими являются амино - и гидрокси-группы. В результате такого взаимодействия получаются азосоединения. Сама реакция протекает по схеме реакции электрофильного замещения в ароматическом ряду суммарная реакция:
![]()
азосоединение
Этот процесс называется реакцией азосочетания.
Реакции замещения ароматических аминов в ядре.
 Аминогруппа
настолько сильно активирует ядро, что
в обычных условиях аминогруппу
предварительно защищают ацилированием.
Если нитровать анилин непосредсвенно,
то получится м-нитроанилиний. Анилин
легко бромируется бромной водой с
образованием триброманилина.
Аминогруппа
настолько сильно активирует ядро, что
в обычных условиях аминогруппу
предварительно защищают ацилированием.
Если нитровать анилин непосредсвенно,
то получится м-нитроанилиний. Анилин
легко бромируется бромной водой с
образованием триброманилина.
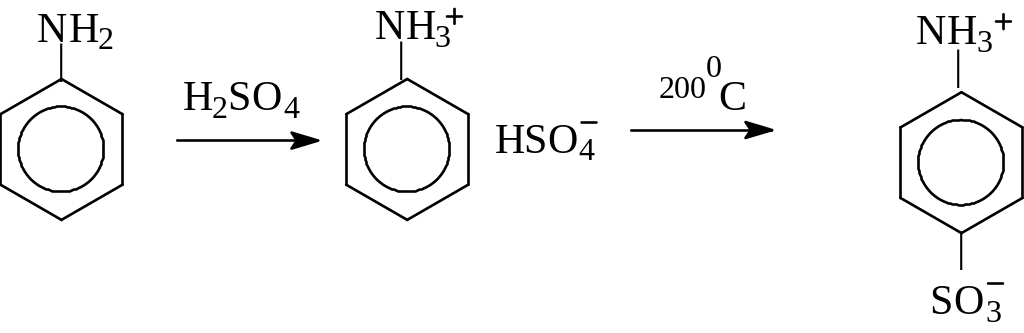
Анилин можно сульфировать, при этом получается
сульфаниловая кислота. Последняя является исходным соединением для получения сульфаниламидных препаратов.
Получение аминов.
1.Амины алифатического ряда можно получить действием амммака на алкилгалогениды. Эта реакция протекает по механизму нуклеофильного замещения.

О днако
реакция не останавливается на этой
стадии. Полученный метиламмоний иодид
при действии избытка аммиака может
образовывать свободный метиламин,
который является нуклеофилом, и может
подвергнуться дальнейшему алкилированию.:
днако
реакция не останавливается на этой
стадии. Полученный метиламмоний иодид
при действии избытка аммиака может
образовывать свободный метиламин,
который является нуклеофилом, и может
подвергнуться дальнейшему алкилированию.:
Таким путем реакцией алкилирования получают смесь аминов.
2. Восстановительное аминирование карбонильных соединений. Карбонильные соединения могут быть превращены в амины в процессе, называемом восстановительным аминированием и представляющем собой восстановление в присутствии аммиака:

альдегид первичный амин
( кетон ) (вторичный амин)
3. Восстановление нитросоединений. Под действием сильных восстановителей нитросоединения превращаются в первичные амины. Этот метод применяется, в основном, для синтеза ариламинов, так как ароматические нитросоединения более доступны по сравнению с алифатическими. В качестве восстановителей чаще всего используется железо или олово в соляной кислоте, либо водород в присутствии катализатора (например, Pt ).
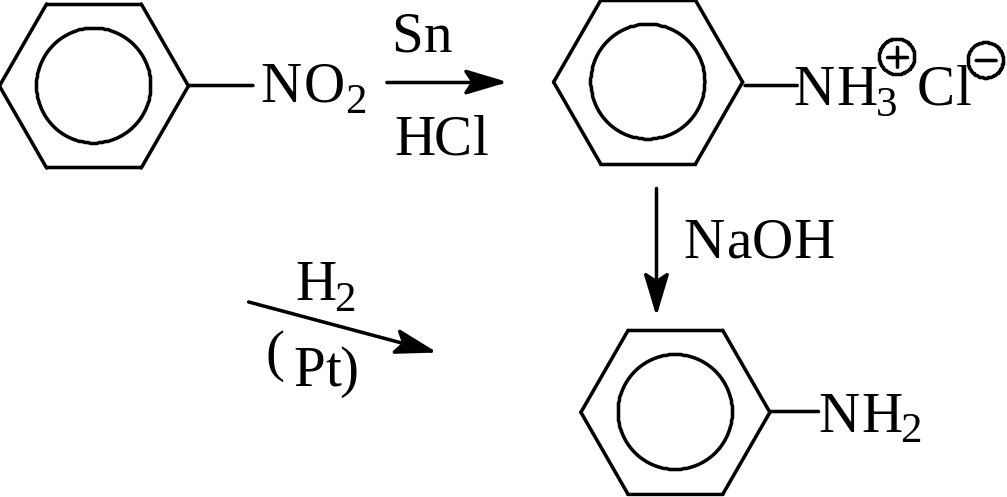
нитробензол анилин
