
- •12. Элементы органической
- •12.1. Введение
- •12.2. Особенности органических соединений
- •12.3. Тип химических связей и валентность углерода в органических соединениях
- •12.4. Основные положения теории
- •Химического строения органических
- •Соединений
- •А. М. Бутлерова
- •Изомерия положения функциональной группы:
- •III. В молекулах органических веществ атомы и группы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
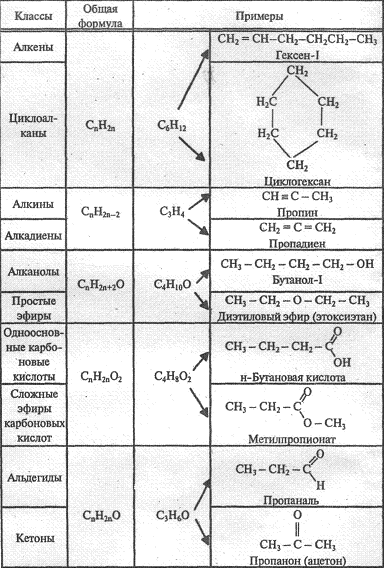
- •12.5. Классификация органических
- •12.6. Номенклатура органических соединений
- •12.8. Углеводороды
- •12.8.1. Классификация углеводородов
- •12.8.2. Алканы (парафины) Определение, общая формула
- •Изомерия и номенклатура алканов
- •Химические свойства алканов
- •II. Реакции окисления
- •IV. Реакции крекинга алканов
- •V. Изомеризация
- •Получение алканов
- •Применение
- •12.8.2. Алкены (олефины, этиленовые ув) Определение, общая формула
- •I. Реакции присоединения
- •III. Реакции полимеризации
- •IV. Изомеризация.
- •V. Реакции замещения
- •Получение
- •Реакции присоединения
- •12.8.4. Алкины (ацетиленовые ув)
- •Изомерия и номенклатура
- •Химические свойства
- •II.Реакции окисления
- •III. Реакции полимеризации
- •IV. Реакции замещения атомов «н», связанных с sp-гибридизованными атомами углерода
Изомерия положения функциональной группы:
 СН3
– СН2
–СН2
– ОН
СН3
– СН2
–СН2
– ОН

С![]() Н7ОН
Н7ОН
СН3 – СН – СН3
׀
ОН
2. Пространственная изомерия (геометрическая изомерия, цис- транс-изомерия) обусловлена различным расположением химических связей атомов углерода в пространстве:
Н 3С СН3 Н 3С Н
С = С С = С
Н Н Н Н3С
цис-изомер транс-изомер
( t°кип. = 3,7°С) (t°кип. = 0,9°С)
Порядок соединения атомов в этих изомерах одинаковый, но расположение атомов в пространстве различно.
Цис-изомеры содержат определённые (в частном случае одинаковые) атомы или группы атомов при углеродах с двойной связью по одну сторону от этой двойной связи, транс-изомеры – по разные стороны.
Если изомеры относятся к одному классу органических веществ, то различия в их химических свойствах не очень существенны.
3. Межклассовая изомерия – изомерия веществ, принадлежащих к разным классам органических соединений:
Изомеры, относящиеся к разным классам веществ, могут иметь совершенно непохожие свойства.
Например, этанол СН3–СН2–ОН, представляющий класс спиртов, при обычных условиях жидкость, (t°кип. = 78°С), активно взаимодействует с металлическим натрием. А метоксиметан (диметиловый эфир) СН3–О–СН3 , относящийся к классу простых эфиров, газ (t°кип. = -25°С), с натрием не реагирует.
III. В молекулах органических веществ атомы и группы атомов влияют друг на друга. Это взаимное влияние определяет свойства веществ.
Например, как известно, уксусная кислота СН3СООН является слабой кислотой, т. е. ее диссоциация происходит в малой степени:
О О
 СН3
–
С
СН3
–
С![]() СН3
–
С
+
Н+
СН3
–
С
+
Н+![]()
О – Н О–
Если атомы водорода, связанные с атомом углерода заместить атомами фтора, то получается трифторуксусная кислота CF3COOH, которая относится к сильным кислотам, диссоциирующим практически необратимо:
О О
СF3 – С СF3 – С + Н+
О – Н О–
Следовательно, атомы фтора оказывают влияние на диссоциирующую группу О—Н.
С точки зрения современных представлений о строении атомов и химической связи, взаимное влияние атомов в молекулах обусловлено смещением электронной плотности от одних атомов к другим атомам. Это смещение, как вы уже знаете, происходит в направлении атомов с большей электроотрицательностью.
Существует два важнейших эффекта влияния заместителей (атомы и атомные группы в молекулах органических соединений могут быть объединены общим названием заместители) на распределение электронной плотности в молекуле — индуктивный и мезомерный эффекты.
Индуктивный эффект (I) — это смешение электронной плотности вдоль σ-связи от одного атома к другому вследствие их разной электроотрицательности. При этом происходит поляризация связи.
Атомы или группы атомов, электроотрицательность которых больше электроотрицательности атома углерода, в связях с ним оттягивают на себя электроны связи и обладают отрицательным индуктивным эффектом –I (электроноакцепторы):
׀δ+ δ-
 – С Х –I
– С Х –I
׀
К ним относятся:
O O
–F, –CI, –Br, –I, –OH, –NH2, –CN, –NO2, – C , – C , – O – и др.
H OH
Атомы и группы с меньшей электроотрицательностью отталкивают от себя электроны в связях с углеродом и обладают положительным индуктивным эффектом + I (электронодоноры):
׀δ- δ+
– С
![]() Х +I
Х +I
׀
К ним относятся:
–СН3, –СН2–СН3, –СН(СН3)2, –С(СН3)3 и др.
I эффект передаётся по цепи σ-связи и быстро уменьшается при удалении от заместителя, вызывающего этот эффект:
δ “+ δ’+ δ–
СН3 → СН2 → Cl δ’+ > δ”+
В трифторуксусной кислоте три атома фтора, обладающие самой большой электроотрицательностью, оттягивают к себе электронную плотность σ-связей С – F: возникающий на атоме углерода положительный заряд δ+ обусловливает смещение электронной плотности от соседнего атома углерода и появлению на нем положительного заряда δ΄+; это, в свою очередь, уменьшает смещение электронной плотности от атома углерода к атому кислорода, а в результате увеличивается полярность связи О – Н и облегчается разрыв этой связи с образованием ионов Н+.
Все вышеописанное можно показать структурной формулой, в которой смещение электронной плотности показано стрелками:

F δ-
О
δ+
δ΄+
![]()
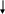
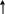 F
C
C
F
C
C
О – Н
F
Рассматривая индуктивный эффект, необходимо отметить, что атомы углерода, находящиеся в различных гибридных состояниях, имеют разную электроотрицательность:
![]()
Поэтому,
например, в молекуле пропена
СН3—СН=СН2
группа
СН3
проявляет положительный +I-эффект.
При передаче индуктивного эффекта этой
группы на двойную связь, в первую очередь,
ее влияние испытывают электроны
подвижной
![]() -связи
(смещение ее электронной плотности
обозначают изогнутой стрелкой):
-связи
(смещение ее электронной плотности
обозначают изогнутой стрелкой):

Мезомерный эффект (эффект сопряжения) М характерен для соединений с сопряженными связями, в которых простые связи чередуются с кратными связями или (и) с атомами, имеющими неподеленные электронные пары (О, S, N).
Мезомерный эффект (М) — это поляризующее влияние атома или группы атомов, проявляющееся в смещении электронов -связей или неподеленных электронных пар отдельных атомов (О, S, N) в сторону атомов с недостроенной до октета электронной оболочкой. В результате на противоположных концах системы появляются одинаковые по величине, но разные по знаку заряды. Электронное смещение обозначается изогнутой стрелкой:
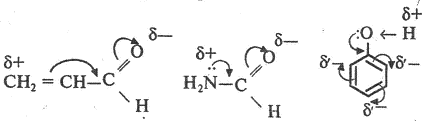
Электронодонорные группы, способные к частичной или полной передаче пары электронов, обладают положительным мезомерным эффектом (+М), а электроноакцепторные группы, поляризующие систему в противоположном направлении, — отрицательным (–М).
Мезомерный эффект передается по цепи сопряженных связей без ослабления.
Мезомерный эффект атомов или группы атомов может совпадать по знаку с индуктивным эффектом, но может иметь и противоположный знак, например, атом хлора обладает отрицательным индуктивным эффектом и положительным мезомерным эффектом.
Таблица 2
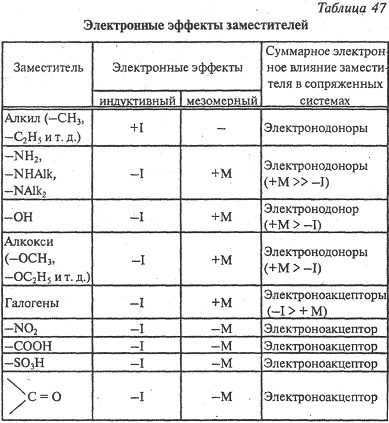
В целом при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать суммарное действие индуктивного и мезомерного эффектов. Все заместители в зависимости от того, повышают они или понижают электронную плотность в молекуле, рассматривают как электронодонорные или электроноакцепторные (табл. 2).
