
Фазовые диаграммы двойных систем
Рассмотренные ранее фазовые превращения в чистых металлах (плавление, кристаллизация, полиморфизм) происходят и в сплавах. В сплавах идут и другие фазовые превращения. Для их анализа используются фазовые диаграммы (или Диаграммы состояния), позволяющие устанавливать фазовый состав и структуру сплавов в зависимости от их химического состава и температуры.
(Правило фаз).
Определим сначала предмет изучения, который назовем Системой. Она включает в себя две составляющие – материальную и термодинамическую.
Под материальной системой вообще понимают часть пространства, заполненного веществом, которое выделяют для исследования.
Остальной окружающее пространство называют внешней средой.
С физической точки зрения есть понятия термодинамической и физико-химической систем.
Термодинамическая система (или просто система) – это часть пространства, в котором объекты могут обмениваться между собой энергией.
Выбор границ такой системы зависит от конкретной термодинамической задачи.
При полиморфном превращении в железе граница термодинамической системы – поверхность образца, реально отделяющей такую систему от окружающей ее печной атмосферы.
Если анализируется процесс насыщения углеродом из газовой среды, то термодинамическая система должна включать в себя и образец железа, и окружающую его газовую среду.
В физико-химической системе возможен обмен не только энергией, но и веществом.
Ф-х системы- это наиболее распространенные объекты исследования. В металловедении такими системами являются чистые металлы и металлические сплавы, т.е. вещества, которые при изменении внешних условий (температура, давление) могут претерпевать различные превращения.
В металловедении физико-химическими системами является совокупность бесконечно большого числа сплавов, которые можно получить при сплавлении двух и большего числа металлов (например, системы Fe-C, Al-Cu, Mg-Al-Zn и др).
Они могут состоять из одной фазы – гомогенные - или нескольких фаз – гетерогенные.
Слайд 1. Основные определения
Фаза - это гомогенная часть гетерогенной системы одинаковая по всем свойствам, не зависящим от массы.
Например, при температуре плавления в железе могут существовать расплав и кристаллы железа; Совокупность всех кристаллов железа представляет самостоятельную твердую фазу.
Компоненты – это химические эдементы, наименьшее число которых достаточно для образования всех фаз термодинамической системы. Компонентами углеродистой стали будут железо и углерод, компонентами латуни – медь и цинк.
Каждая фаза системы характеризуется термодинамическими параметрами: температурой, давлением, концентрацией компонентов.
Система будет находиться в равновесии при постоянных внешних условиях во времени и отсутствием в системе потоков энергии и вещества - Равновесное состояние
Фазовое (гетерогенное) равновесие – это равновесное состояние системы, состоящей их двух и более числа фаз.
Термодинамические степени свободы – это термодинамические параметры равновесной системы, которым можно придавать произвольные (в некотором интервале) значения так, чтобы не появлялись новые фазы и не исчезали старые фазы.
Число термодинамических степеней свободы называют вариантностью системы. Если вариантность системы =0 – нонвароиантная, 1 – моновариантная, 2 – дивариантная.
Правило фаз.
(С) = К – Ф + 2
2 – Число внешних независимых переменных – температура, давление.
При одинаковом составе двух фаз вариантность определяется зависимостью:
(С) = 3 – Ф, т.е. система, ведет себя как однокомпонентная.
При обработке и эксплуатации металлических материалов внешнее давление редко выходит за пределы 1-10 МПа, и его влиянием в таких случаях можно пренебречь. Тогда мы имеем следующие выражения: (С) = К – Ф + 1; (С) = 2 – Ф.
Химический состав двухкомпонентного сплава и любой из его фаз изображается точкой на оси концентраций. Отрезок АВ (рис. 3.1) принимают за 100% компонента (А и В).
А-------------------------------------------------------------- В
С
А-------------------------------------------------------------- В
С F D
Суммарное содержание компонентов всегда равно 100%.
Концентрации компонентов выражаются в процентах по массе или в атомных процентах. Атомные проценты, характеризующие отношение числа атомов данного компонента к числу всех атомов, используют, как правило, в теоретических работах. При решении практических задач чаще пользуются размерностью по массе (% масс.).
Правило трех точек
Состав двухфазного сплава всегда находится в промежутке между точками, изображающими составы его фаз. При распаде одной фазы на две составы образующихся фаз всегда находятся по обе стороны от состава исходной фазы.
Правило трех точек позволяет проводить качественный анализ фазового превращения с учетом трех фаз. Пользуясь этим правилом, можно на диаграмме двойной системы любой сложности анализировать даже неизвестное фазовое превращение.
Количественные соотношения определяет правило рычага, также вытекающее из закона сохранения массы.
Слайд. Правило рычага
Математическое выражение этого правила отображает соотношение
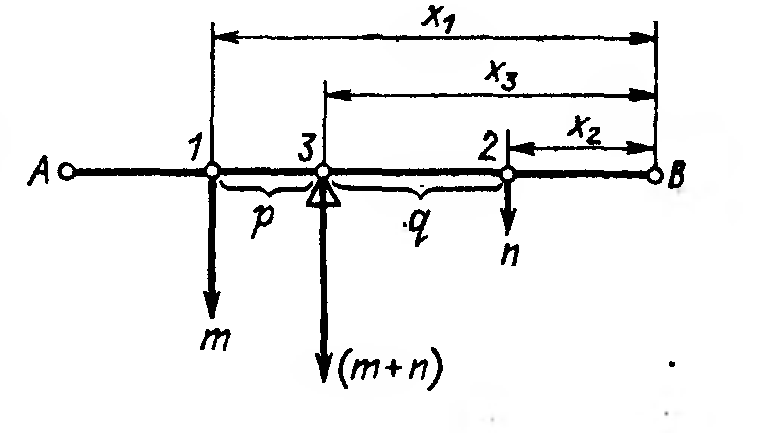
Из этого соотношения, с учетом обозначений, следует, что
m/n = q/p.
Это выражение соответствует известному в механике правилу равновесия рычага первого рода.
Отсюда название «правило рычага» или «правило отрезков».
По правилу рычага определяют, какая доля всей массы сплава приходится на ту или иную фазу в двухфазном сплаве, если известны состав сплава (опора рычага) и составы обеих фаз (концы рычага).
Типы фаз в сплавах
Твердые растворы. Это понятие введено для описания однородных твердых веществ переменного химического состава по аналогии «жидкий раствор».
Кристаллическая решетка твердого раствора всегда того же типа, что и у растворителя (элемента или химического соединения).
Тв. р. замещения. Атомы растворенного элемента замещают атомы растворителя в узлах кристаллической решетки.
Слайд 3. Твердые растворы замещения
Твердые растворы замещения могут образовывать компоненты отвечающие следующим требованиям:
Если разница атомных радиусов элементов превышает 14-15%, то растворимость в твердом состоянии ограничена. Иногда это называют правилом 15% или размерным фактором.
Наиболее устойчивая фаза образуется, если один из элементов становится более электроотрицательным, а другой более электроположительным. Этот принцип известен, как эффект отрицательной валентности.
Большей растворимостью обладают элементы с более низкой валентностью. Это принцип - эффект относительной валентности. Он хорошо соблюдается для одновалентных металлов меди, серебра, золота.
Ряд компонентов может образовывать твердые растворы замещения неограниченной растворимости. Т.е. они смешиваются друг с другом в любом процентном соотношении с образованием сплава на основе твердого раствора.
Для этого также необходимо соблюдение определенных требований.
Если разница атомных радиусов элементов не превышает 5-7%,
Одинаковый тип кристаллических решеток компонентов,
Одинаковая валентность компонентов.
В твердых растворах атомы растворенного вещества, как правило, распределяются статистически.
Вокруг атома растворенного вещества возникают местные искажения пространственной решетки, которые приводят к изменению свойств и среднего периода решетки.
Образование твердых растворов всегда сопровождается увеличением электрического сопротивления и уменьшением температурного коэффициента электросопротивления; твердые растворы обычно менее пластичны (исключение тв. р-ры на основе меди) и всегда более твердые и прочные, чем чистые металлы.
В полиморфных металлах неограниченная растворимость встречается в пределах одной модификации пространственной решетки. Например, Fea дает неограниченный ряд твердых растворов с хромом (ОЦК), а Feg - с никелем (ГЦК).
Сверхструктуры.
Многие твердые растворы замещение при относительно невысоких температурах способны находится в упорядоченном состоянии, т.е. место статистического распределения разносортных атомов в узлах пространственной решетки атомы одного и другого металла размещаются в совершенно определенном порядке. Такие растворы называются упорядоченными. Используется также термин «сверхструктура».
Слайд 4. Сверхструктуры
Переход из не упорядоченного состояния в упорядоченное состояние происходит при определенной температуре или в определенном интервале температур.
Температура, при которой раствор полностью разупорядочивается, называется точкой Курнакова и обозначается Qк.
Сверхструктуры встречаются в системах с неограниченной или значительной растворимостью в твердом состоянии.
Полная упорядоченность наступает при концентрациях твердого раствора, соответствующих простым атомным соотношениям компонентов типа АВ или АВ3.
Частичная упорядоченность наблюдается при составах, близких к указанным. Например, в сплавах Au-Cu возможны следующие варианты упорядочения (ГЦК) – AuCu3 – в вершинах куба – ионы золота, а на диагоналях граней - ионы меди, или же в случае AuCu – ионы золота занимают кристаллографическую плоскость, проходящую через диагонали граней параллельно плоскости 0 0 ½.
Возникновение и исчезновение порядка в расположении атомов сопровождается изменением свойств:
- при упорядочении возрастают электропроводность, температурный коэффициент электросопротивления, твердость и прочность, снижается пластичность сплава. У ферромагнитных сплавов меняются магнитные свойства: например, у пермаллоев (магнитные сплавы железа с никелем) при упорядочении в несколько раз уменьшается магнитная проницаемость. Некоторые сплавы в неупорядоченном состоянии парамагнитны, а после упорядочения становятся ферромагнитными.
Упорядоченные твердые растворы можно рассматривать как промежуточные фазы между растворами и химическими соединениями.
Правильное расположение компонентов в кристаллической решетке характерно для химического соединения, когда резко изменяются свойства.
Однако (!) в упорядоченных твердых растворах в отличие от химического соединения сохраняется кристаллическая решетка растворителя, и при нагревании до определенной температуры (точки Курнакова) степень упорядоченности постепенно уменьшается, а выше этой температуры твердый раствор становится неупорядоченным.
Твердые растворы внедрения
Слайд 2. Твердые растворы внедрения
По способу внедрения в металле растворяются металлоиды с малым атомным радиусом – водород, кислород, азот, углерод, и бор.
Внедренные атомы располагаются в пустотах упаковки атомов растворителя. За исключением водорода все эти элементы имеют размер атомов больше самых крупных октаэдрических пор, и поэтому внедренные атомы смещают вокруг себя атомы растворителя.
Твердые растворы внедрения не обладают неограниченной растворимостью. Концентрация раствора не может быть большей, чем количество всех пустот в решетке растворителя. В реальных же условиях эта величина еще меньше из-за высоких энергий искажения кристаллической решетки при внедрении чужеродных атомов (пример -Fe теоретически – 50%, реально -2,14%).
Твердые растворы вычитания или растворы с дефектной решеткой - образуются на базе химических соединений, при этом возможна замена одних атомов в узлах кристаллической решетки другими и образование пустых, не занятых атомами, узлов в решетке (вакансий).
При образовании твердого раствора к химическому соединению добавляют один из входящих в формулу элемент, его атомы занимают нормальное положение в решетке соединения, а места атомов другого элемента остаются, незанятыми.
В сплавах, содержащих более двух элементов, возможно растворение в одном и том же растворителе и путем замещения, и путем внедрения.
Так, при сплавлении железа с углеродом и марганцем получится твердый раствор, в котором марганец растворяется путем замещения, а углерод – путем внедрения.
В заключении можно сказать, что твердые растворы – это кристаллы наиболее близкие по своим свойствам к растворителю, т.к. сохраняют его кристаллическую решетку и тип связи. Они отличаются высокой технологической пластичностью: хорошо деформируются в горячем, а многие и в холодном состоянии.
Твердые растворы составляют основу большинства промышленных конструкционных сплавов.
Химические соединения. Характерные особенности химических соединений, образованные по закону нормальной валентности соответствуют следующим условиям.
Кристаллическая решетка отличается от кристаллических решеток компонентов, образующих это соединение. Атомы в решетке располагаются упорядочено (закономерно и по определенным узлам кристаллической решетки). Большинство химических соединений имеют сложную кристаллическую структуру.
В соединении всегда сохраняется соответствие между компонентами, которое можно выразить соотношением Am Bn .
Свойства соединения резко отличаются от свойств образующих его компонентов.
Температура плавления (диссоциации) постоянная.
Образование хим.соединения сопровождается значительным тепловым эффектом.
Слайд 5. Химические соединения.
В отличие от твердых растворов хим. соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток.
Химические соединения являются промежуточными фазами, имеющими определенные особенности своего строения.
Промежуточные ФАЗЫ
Промежуточными называют любые кристаллические фазы, кроме твердых растворов на базе компонентов.
Если они образованы металлами, их называют интерметаллидами.
Металлы с неметаллами образуют карбиды, нитриды и др. промежуточные фазы.
Как правило, промежуточные фазы отличаются типом кристаллического строения от элементов, которые их образуют.
Едва ли можно найти системы сплавов, в которых состав промежуточных фаз соответствовал нормальной валентности элементов.
Это – следствие наличия в промежуточных фазах металлической связи, т.е. валентные электроны, могут свободно перемещаться в кристаллической решетке.
Таким образом, эти соединения, вследствие частичного разрушения ковалентной связи обладали промежуточным типом связи между ковалентной и металлической.
Валентные соединения.
Атомы разного сорта связаны ионными и ковалентными связями.
Образуются между типичными металлами и сильно электроотрицательными элементами IVB,VB, VIB групп периодической системы. Среди них преобладают соединения металлов с неметаллами (MgS, Al2O3), но встречаются также и интерметаллиды. Последние образуются типичными (электроположительными) металлами, например, магнием - сильно отрицательными, т.е. сильно притягивающими к себе электроны металлами IVB и полуметаллами VB группы (Mg2Sn, Mg2Pb, Mg3Sb2).
Валентные соединения характеризуются стехиометрическим составом и узкой областью гомогенности на ДС.
Многие валентные соединения на фазовой диаграмме изображаются в виде ординаты. В структуре валентного соединения атомы каждого сорта занимают строго определенные положения в кристаллической решетке, образуя свои подрешетки.
Например, в соединении Mg2Si атомы кремния занимают все вершины и центры граней кубической решетки, а атомы магния располагаются по два на пространственных диагоналях куба на расстоянии ¼ от вершин.
Фазы Юм-Розери (электронные фазы).
Тип межатомной связи металлический. Для них характерна большая область гомогенности на ДС.
Такие фазовые диаграммы систем образуют, например, с одной стороны медь, серебро или золото с элементами подгрупп В ПС (цинк, кадмий, алюминий). После широкой области граничного твердого раствора (ограниченные твердые растворы по типу замещения) следуют промежуточные фазы на основе компонентов системы.
Число валентных электронов приходящихся в среднем на один атом, называют электронной концентрацией (е/а).
У рассмотренных соединений е/а=3/2(1,48) – на 3 электрона приходится 2 атома. Такие фазы -
3/2 – ОЦК, сложную кубическую или гексагональную и обозначаются как b-соединения (CuBe, CuZn, Cu3Fl, и др).
Существуют и другие соединения, у которых это отношение равно 21/13 (1,62)
– имеют сложную решетку и называются g-фазой (Cu3Zn8, Cu9Al4);
7/4 (1,75) – плотноупакованная гексагональнальная решетка, обозначается e-фазой (CuZn3, Cu3Si, Au3Sn).
Итак, электронные соединения имеют кристаллическую решетку отличную от решетки образующих их компонентов и образуют твердые растворы в широком интервале концентраций.
Фазы Юм-Розери встречаются во многих промышленных сплавах (латунь, бронза и др.). Они имеют сравнительно невысокие температуры плавления, находящиеся, как правило, между температурами плавления образующих их элементов.
Промежуточные фазы внедрения.
Переходные металлы и металлоиды с малым атомным радиусом (углерод, азот, бор и водород) – образуются промежуточные фазы карбиды, нитриды, бориды гидриды.
Их структуру можно представить как кристаллическую решетку металла с внедренными в междуузлия атомами металлоида.
В отличие от граничного твердого раствора внедрения, имеющего кристаллическую решетку металла-основы, в промежуточной фазе внедрения атомы металла располагаются по узлам решетки, не свойственной данному металлу в чистом виде. Например, в карбиде титана, который представляет собой промежуточную фазу внедрения, атомы титана находятся в узлах ГЦК решетки, а чистый титан и граничный раствор углерода в нем при 200С имеют ГП решетку.
Промежуточные фазы внедрения часто называют просто фазами внедрения. Их обозначают формулами М4Х (Fe4N) , М2Х (W2C,) , МХ (WC, TiC) , и др.
Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов атомов металла неметалла (Rн) и металла (Rм).
Если Rн)/ Rм < 0,59, то атомы металла в этих фазах образуют одну из простых решеток: кубическую (К8, К12) или гексагональную (К12), в которые внедряются атомы неметалла, занимая в ней определенные поры (их еще называют фазами Хэгга).
При rx/rm>0,59 промежуточные фазы имеют более сложную решетку. К таким фазам относятся все бориды и карбиды железа и марганца.
Тип связи – металлический.
Большая твердость, хрупкость и высокая температура плавления говорит о том, что между атомами металла и металлоида существуют и ковалентные связи.
Например, карбид тантала TaC плавится при температуре около 38000С.
Фазы Лавеса.
Существование фаз Лавеса определяется размерным фактором. Имеют формулу АВ2 и образуются между компонентами типа А, В при отношении атомных диаметров DA /DB @1,2 (чаще 1,1 – 1,6).
Такое соотношения размеров атомов позволяет им наиболее плотным образом заполнить пространство. Каждый атом А окружен 12 атомами В и на несколько большем расстоянии четырьмя атомами А.
Следовательно, координационное число для атомов А равно 12+4=16 (в решетке из атомов одного вида максимально возможное координационное число- 12)
Фазы Лавеса имеют ГП решетку (MgZn2, MgNi2) или ГЦК (MgCu2).
Сигма-фазы.
Образуются при взаимодействии переходных металлов VA – VIA подгрупп с металлами VIIA – VIII групп, имеющих близкие размеры атомов. Ряд исследователей относят -фазы к электронным соединениям - е/а 7- (атомные радиусы металлов, образующих эти фазы отличаются не более чем на 8%).
Имеют частично упорядоченную сложную решетку с 30 атомами в элементарной ячейке. Стехиометрическая формула АВ (FeCr, FeV), многие из них имеют широкий интервал гомогенности.
Некоторые -фазы устойчивы в ограниченном интервале температур и распадаются на смесь, состоящую из другой промежуточной фазы и граничного раствора на основе переходного металла.
В железных сплавах при содержании хрома более 20% (коррозионостойкие стали), медленное охлаждение их области твердого раствора или при изотермической выдержке при 8000С приводит к образованию сигма-фаз, которые вызывают увеличение твердости и охрупчивание.
Появление этих фаз отрицательно сказывается на технологических и эксплуатационных характеристиках, поэтому их присутствие в сплавах допускать нельзя.
Соединения с нормальной валентностью. Это промежуточные фазы, которые образуются между типичными металлами и элементами, обладающими и металлическими, и неметаллическими свойствами. Для этих промежуточных фаз характерен постоянный состав или очень узкие области гомогенности. Стехиометрические формулы таких соединений подчиняются правилам химической валентности.
