
Федеральное агентство по образованию
Федеральное государственное образовательное учреждение
высшего профессионального образования
«ЮЖНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
Мальцев Ю.Ф.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к лабораторной работе
ЭКСПЕРИМЕНТАЛЬНАЯ ПРОВЕРКА БОРОВСКОЙ МОДЕЛИ АТОМА ВОДОРОДА
для студентов дневного и вечернего отделений физического факультета
Ростов-на-Дону
2009
Методическое указание разработали:
Мальцев Ю.Ф. - кандидат физико-математических наук, доцент кафедры общей физики,
Печатается в соответствии с решением кафедры общей физики физического факультета ЮФУ
![]() Протокол
№ 4 от 29.09.2009 г.
Протокол
№ 4 от 29.09.2009 г.
Цель работы: Уяснить природу серии Бальмера. Наблюдать визуально серию Бальмера с помощью монохроматора УМ-2. Проградуировать монохроматор УМ-2. Определить длины волн серии, их частоты и энергии. Экспериментально получить значение постоянной Ридберга R.
Техника безопасности
В работе используются приборы, питаемые напряжением 220 В, 50 Гц . Перед включением проверить надежность заземления используемых приборов. Не допускается включение источников без соответствующих блоков питания. Нельзя смотреть на включенную ртутную лампу. Включать прибор только с разрешения преподавателя или лаборанта.
Закономерности в спектре атома водорода
Опыт показывает, что спектры невзаимодействующих атомов, как это имеет место для разреженных газов, состоят из отдельных линий, сгруппированных в серии. На рис. 1 показаны линии серии спектра атома водорода, расположенные в видимой области. Длина волны, соответствующая линиям в этой серии, называемой серией Бальмера, выражается формулой
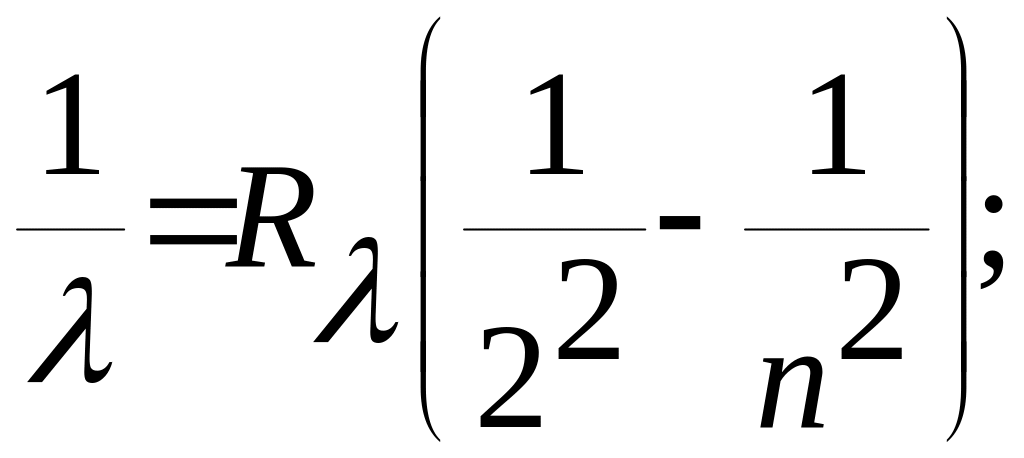 (1)
(1)
где,
n
= 3, 4, 5, ...; ![]() - постоянная Ридберга.
- постоянная Ридберга.

Рис. 1. Линии серии Бальмера дл спектра атома водорода
Линия, соответствующая n = 3, является наиболее яркой и называется головной, а значению n = ∞ соответствует линия, называемая границей серии.
В других областях спектра (ультрафиолетовой, инфракрасной) также были обнаружены серии линий. Все они могут быть представлены обобщенной формулой Бальмера - Ридберга
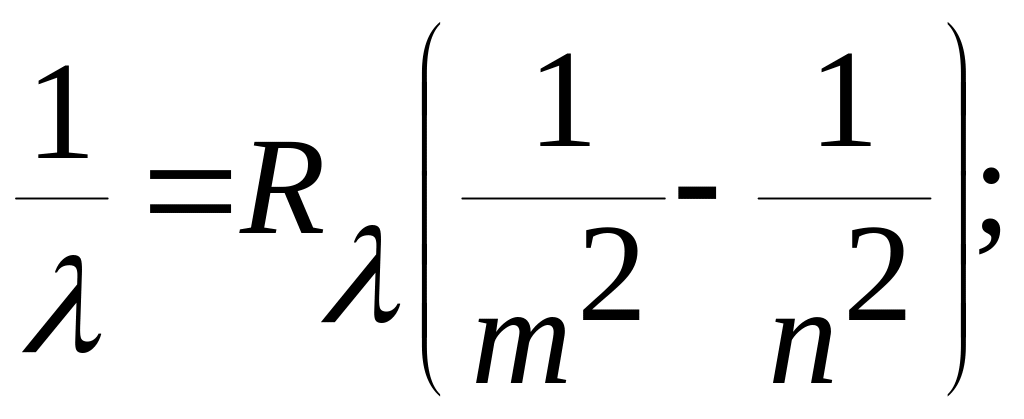 (2)
(2)
где m - целое число, постоянное для каждой серии.
При m = 1; n = 2,3,4, ... - серия Лаймана. Наблюдается в ультрафиолетовой области. При m = 2; n = 3,4,5, ... - серия Бальмера - в видимой области. При m = 3; n = 4,5,6, ... - серия Пашена - в инфракрасной (ИК) области. При m = 4; n = 5,6,7, ... - серия Брэкета - тоже в ИК области и т. д.
Дискретность в структуре атомных спектров указывает на наличие дискретности в строении самих атомов. Для энергии квантов излучения атомов водорода можно записать следующую формулу
 (3)
(3)
Постулаты Бора
Первая квантовая теория строения атома быда предложена в 1913 г. датским физиком Нильсом Бором. Она была основана на ядерной модели атома, согласно которой атом состоит из положительно заряженного ядра, вокруг которого вращаются отрицательно заряженные электроны. Теория Бора основана на двух постулатах.
I постулат Бора - постулат стационарных состояний. В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергию. Этим стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением энергии.
II постулат Бора получил название "правило частот". При переходе электрона с одной стационарной орбиты на другую излучается (или поглощается) квант энергии, равный разности энергий стационарных состояний
![]() (4)
(4)
где h - постоянная Планка; v - частота излучения (или поглощения) энергии; hv - энергия кванта излучения (или поглощения); En и Em - энергии стационарных состояний атома до и после излучения (поглощения), соотвественно. При Em < En происходит излучение кванта энергии, а при Em > En - поглощение.
По теории Бора значение энергии электрона в атоме водорода равно
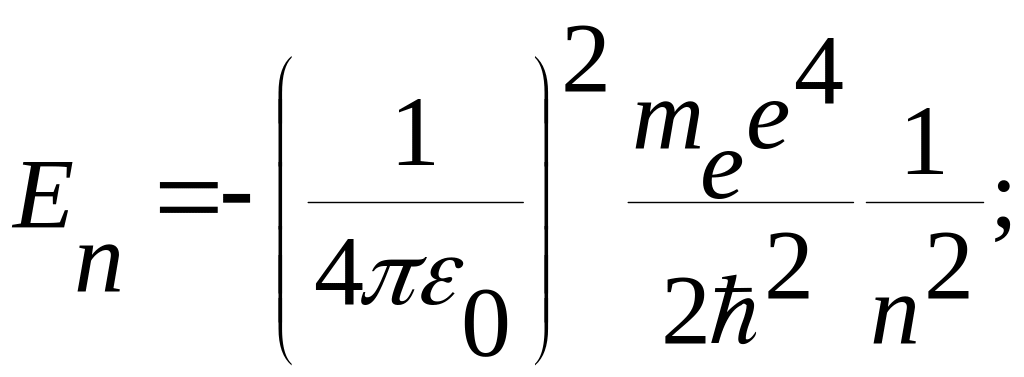 (5)
(5)
где
me
- масса электрона,
e - заряд
электрона,
εe
- электрическая постоянная ,
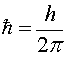 ,
h - постоянная
Планка,
n - целое
число, n = 1,2,3,...
,
h - постоянная
Планка,
n - целое
число, n = 1,2,3,...
Таким образом, энергия электрона в атоме представляет собой дискретную величину, которая может изменяться только скачком.
Набор возможных дискретных частот квантовых переходов определяет линейчатый спектр атома
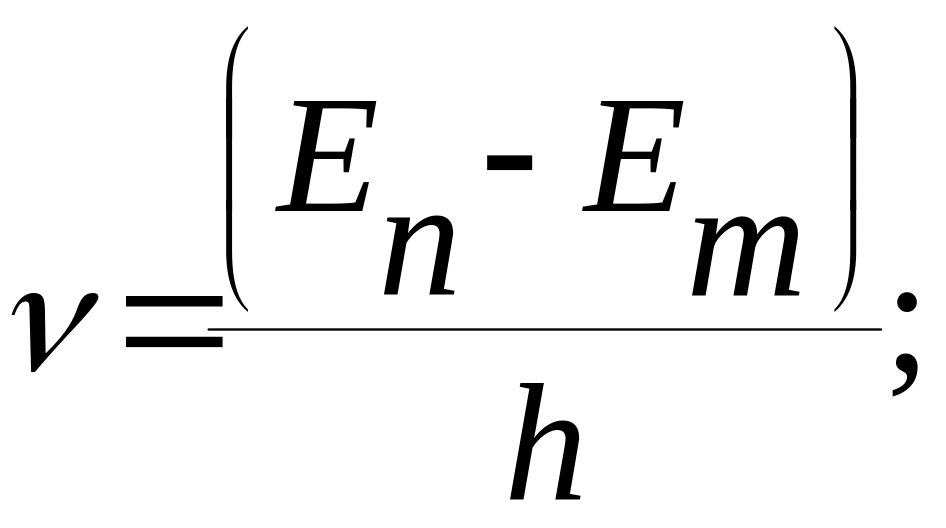 (6)
(6)
Вычисленные по этой формуле частоты спектральных линий для водородного атома оказались в прекрасном согласии с экспериментальными данными. Но теория не обясняла спектры других атомов (даже следующего за водородом гелия). Поэтому теория Бора была только переходным этапом на пути построения теории атомных явлений. Она указывала на неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире.
