
- •Лабораторная работа№2 Определение массовой доли Fe и (nh4)2Fe(so4)2· 6h2o в техническом образце соли Мора.
- •1.Химическая сущность определения:
- •2.Предварительные вычисления.
- •2.1. Расчёт величины навески:
- •2.2. Расчёт количества окислителя:
- •2.3. Расчёт количества осадителя:
- •3. Методика определения.
- •4. Вычисления результатов анализа.
- •I способ(через молярные массы эквивалентов):
- •II способ (через аналитический множитель, фактор пересчета):
- •5.Оформление лабораторной работы в лабораторном журнале.
- •5.4. Химическая сущность определения.
4. Вычисления результатов анализа.
Пример расчёта (задача):
Вычислить процентное содержание Fe и (NH4)2Fe(SO4)2·6H2O в техническом образце соли Мора, если масса навески равна 0,7025г, а масса Fe2О3, полученного после прокаливания – 0,1035г.
Дано:
mн = 0,7025г
a (Fe2О3) = 0,1035г.
Мэ ((NH4)2Fe(SO4)2·6H2O) = м/3 = 130,71 г/моль
Мэ (Fe2О3) = М/6= 26,61 г/моль
Мэ (Fe) = М/3 = 18,62 г/моль
W(Fe) = ? W((NH4)2Fe(SO4)2*6H2O) = ?
2

 (NH4)2Fe(SO4)2·6H2O
H2
SO4
2Fe 2+
НNО3
2Fe3+
NH3
*
H2O
(NH4)2Fe(SO4)2·6H2O
H2
SO4
2Fe 2+
НNО3
2Fe3+
NH3
*
H2O
N

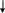 H3
*H2O
2Fe(НО3)
t
Fe2О3
H3
*H2O
2Fe(НО3)
t
Fe2О3
Осаждаемая Гравиметрическая
форма форма
I способ(через молярные массы эквивалентов):
W (Fe) = 0,1035* 18,62 * 100 = 10,31%
26,615 * 0,7025
1) Сколько моль-экв Fe2О3 содержится в гравиметрической форме? Столько же моль-экв Fe содержится в навеске.
2) Сколько г Fe содержится в навеске?
3) Сколько г Fe содержится в 1г образца?
4) Сколько г Fe содержится в 100г образца или W (Fe)?
W ((NH4)2Fe(SO4)2·6H2O) = 0,1035 * 130,71 * 100 = 73,36 %
26,615 * 0,7025
1) Сколько моль-экв Fe2О3 содержится в гравиметрической форме? Столько же моль-экв (NH4)2Fe(SO4)2·6H2O содержится в навеске.
2) Сколько г (NH4)2Fe(SO4)2·6H2O содержится в навеске?
3) Сколько г (NH4)2Fe(SO4)2·6H2O содержится в 1г образца?
4) Сколько г (NH4)2Fe(SO4)2·6H2O содержится в 100г образца или W(NH4)2Fe(SO4)2·6H2O?
II способ (через аналитический множитель, фактор пересчета):
F 2Fe / Fe2О3 = 0,6994
F 2(NH4)2Fe(SO4)2*6H2O / Fe2О3 = 4,9111
W (Fe)= 0,1035 * 0,6994* 100 = 10,35%
0,7025
1) Сколько г Fe содержится в навеске?
2) Сколько г Fe содержится в 1г образца?
3) Сколько г Fe содержится в 100г образца или W(Fe)?
W ((NH4)2Fe(SO4)2·6H2O)= 0,1035*4,9111 *100 = 73,36%
0,7525
1) Сколько г (NH4)2Fe(SO4)2·6H2O содержится в навеске?
2) Сколько г (NH4)2Fe(SO4)2·6H2O содержится в 1г образца?
3) Сколько г (NH4)2Fe(SO4)2·6H2O содержится в 100г образца или W ((NH4)2Fe(SO4)2·6H2O?
5.Оформление лабораторной работы в лабораторном журнале.
5.1.Название лабораторной работы
5.2.Метод анализа:
5.3.Цель работы:
5.4. Химическая сущность определения.
( NH4)2Fe(SO4)2*6H2O H2 SO4 ….. . …… …… ……
5.5. Определить молярные массы эквивалентов (по химической сущности определения):
Мэ (Fe) =
Мэ (NH4)2Fe(SO4)2·6H2O =
5.6. Расчет массы навески технического образца соли Мора (NH4)2Fe(SO4)2·6H2O для гравиметрического определения.
5.7..Взвешивание навески соли Мора (NH4)2Fe(SO4)2·6H2O.
1 |
Масса стекла с навеской, г |
|
2 |
Масса стекла, г |
|
3 |
Масса навески,г |
|
5.8.Прокаливание и доведение пустого тигля до постоянной массы.
№п/п |
Результаты взвешивания пустого тигля г |
|
|
|
|
|
|
|
|
|
Постоянная масса пустого тигля:______________________
5.9. Прокаливание тигля с осадком (гравиметрической формой) до постоянной массы.
№ п/п |
Результаты взвешивания тигля с осадком Fe2О3 |
|
|
|
|
|
|
|
|
Масса тигля с гравиметрической формой Fe2О3 ________________________________________
5.10. Нахождение массы гравиметрической формы
Масса тигля с гравиметрической формой Fe2О3 |
|
Масса пустого тигля |
|
Масса гравиметрической формой Fe2О3 |
|
6. Вычисления результатов анализа W (Fe) , W ((NH4)2Fe(SO4)2·6H2O).
См ПП4. пример вычисления результатов анализа.
В формулы подставлять свои результаты анализа!!!!!!!, в примере задача!
