
- •1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •2. Зависимость скорости реакции от температуры.
- •2.1 Ход опыта.
- •2.2 Расчет и анализ экспериментальных данных.
- •3. Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ.
- •3.1 Ход опыта.
- •3.2 Расчет и анализ экспериментальных данных.
- •4. Влияние концентрации реагирующих веществ на состояние равновесия.
- •4.2 Расчет и анализ экспериментальных данных.
- •5.Влияние температуры на состояние равновесия.
- •5.1 Ход опыта.
- •5.2 Расчет и анализ экспериментальных данных.
Экспериментальная часть.
Цель работы: изучить влияние различных факторов на кинетику и равновесие физико-химических процессов.
1. Зависимость скорости реакции от концентрации реагирующих веществ.
1.1 Ход опыта.
Для выполнения опыта используем
растворы: раствор А (0.002н раствор иодата
калия
![]() ),
раствор Б (0.02н раствор сульфита натрия,
содержащего в 500 мл 0.02н раствора
),
раствор Б (0.02н раствор сульфита натрия,
содержащего в 500 мл 0.02н раствора
![]() ,
50 мл 2н раствора серной кислоты
,
50 мл 2н раствора серной кислоты
![]() и 50 мл 1% раствора крахмала). В опыте нам
понадобиться раствор Б в пяти различных
концентрациях: для этого в пять пробирок
нальем по 10 мл раствора Б и в каждую из
них накапаем дистиллированную воду в
соответствии 1-я пробирка 0 капель, 2-я
5капель,3-я 10 капель, 4-я 15 капель, 5-я 20
капель. Теперь сливая 20-ть капель
раствора А с 20-тью каплями раствора Б
из 1-ой пробирки будем засекать время
до появления синего окрашивания. Проведем
этот опыт с остальными пробирками,
содержащими раствор Б. Для каждого
случая рассчитаем скорость реакции.
и 50 мл 1% раствора крахмала). В опыте нам
понадобиться раствор Б в пяти различных
концентрациях: для этого в пять пробирок
нальем по 10 мл раствора Б и в каждую из
них накапаем дистиллированную воду в
соответствии 1-я пробирка 0 капель, 2-я
5капель,3-я 10 капель, 4-я 15 капель, 5-я 20
капель. Теперь сливая 20-ть капель
раствора А с 20-тью каплями раствора Б
из 1-ой пробирки будем засекать время
до появления синего окрашивания. Проведем
этот опыт с остальными пробирками,
содержащими раствор Б. Для каждого
случая рассчитаем скорость реакции.
Таблица 1.
номе стака-на |
объем, мл |
относительная концентрация раствора Б (нормальность) |
время t,с |
относительная скорость реакции
|
|
раствор Б |
дистиллированная вода |
||||
1 2 3 4 5 |
10 10 10 10 10 |
0 5 10 15 20 |
0.02 0.0133 0.01 0.008 0.0066 |
9 14 18 26 36 |
0.11 0.7 0.056 0.038 0.028 |
1.2 Расчет и анализ экспериментальных данных.
Запишем уравнение реакции.
![]() .
В ионном виде:
.
В ионном виде:
![]()
Признаком протекания реакции является
появление синего окрашивания
(взаимодействие йода с крахмалом).Произведем
расчет скорости химических реакций по
полученным данным.
,
:
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() .Занесем
полученные результаты в таблицу 1.
.Занесем
полученные результаты в таблицу 1.
П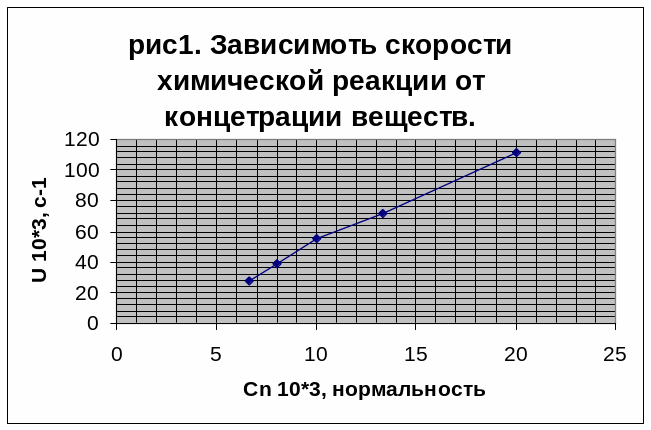 о
результатам в таблице1 построим график
зависимости скорости реакции от
концентрации веществ рис1.
о
результатам в таблице1 построим график
зависимости скорости реакции от
концентрации веществ рис1.
График скорости должен изображаться прямой линией. На графике получилась ломанная, это можно объяснить погрешностью в вычислениях, т.к. были округлены значения скорости и не точно найдено время.
1.3 Вывод.
В результате лабораторного опыта было установлено, что скорость химической реакции зависит от концентрации веществ: чем выше концентрация реагирующих веществ в нашем опыте, тем быстрее появляется синее окрашивание, то есть время протекания реакции уменьшается, это происходит по тому, что в растворе увеличивается количество частиц и следовательно увеличивается количество эффективных соударений этих частиц.
* * *
2. Зависимость скорости реакции от температуры.
2.1 Ход опыта.
Берем 2-е пробирки, в одну помещаем
20-ть капель 0,1н раствора щавелевой
кислоты
![]() ,
а в другую 20-ть капель перманганата
калия
,
а в другую 20-ть капель перманганата
калия
![]() и 20-ть капель концентрированной серной
кислоты
.
Охлаждаем полученную смесь на воздухе.
Потом нагреваем пробирки до 300С
в воде (нагретой на электроплитке),
производим смешивание, при этом засекаем
время от сливания веществ до полного
их обесцвечивания. Этот опыт проводим
еще три раза при температурах 40, 50, 600С.
Для каждого случая рассчитаем скорость
реакции.
и 20-ть капель концентрированной серной
кислоты
.
Охлаждаем полученную смесь на воздухе.
Потом нагреваем пробирки до 300С
в воде (нагретой на электроплитке),
производим смешивание, при этом засекаем
время от сливания веществ до полного
их обесцвечивания. Этот опыт проводим
еще три раза при температурах 40, 50, 600С.
Для каждого случая рассчитаем скорость
реакции.
Таблица2.
номе опыта |
температура T, C |
время от начала реакции до конца t, C |
относительная скорость реакции , |
1 2 3 4 |
30 40 50 60 |
38 15 5 3 |
0,026 0,067 0,167 0,33 |
