
- •1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •2. Зависимость скорости реакции от температуры.
- •2.1 Ход опыта.
- •2.2 Расчет и анализ экспериментальных данных.
- •3. Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ.
- •3.1 Ход опыта.
- •3.2 Расчет и анализ экспериментальных данных.
- •4. Влияние концентрации реагирующих веществ на состояние равновесия.
- •4.2 Расчет и анализ экспериментальных данных.
- •5.Влияние температуры на состояние равновесия.
- •5.1 Ход опыта.
- •5.2 Расчет и анализ экспериментальных данных.
2.2 Расчет и анализ экспериментальных данных.
Запишем уравнение реакции
![]()
![]() или в ионной форме
или в ионной форме
![]()
Признаком реакции является восстановление
в кислой среде иона
![]() в ион
в ион
![]() .
Из красно-фиолетового цвета (цвета иона
)
раствор окрашивается в бледно-розовый
(цвет иона
при большей концентрации) или
обесцвечивается (при малой концентрации).
.
Из красно-фиолетового цвета (цвета иона
)
раствор окрашивается в бледно-розовый
(цвет иона
при большей концентрации) или
обесцвечивается (при малой концентрации).
Произведем расчет скорости химических реакций по полученным данным. , :
![]() ;
;
![]() ;
;
![]()
![]() Занесем полученные результаты в таблицу
2. По результатам в таблице2 построим
график зависимости скорости химической
реакции от температуры рис2..
Занесем полученные результаты в таблицу
2. По результатам в таблице2 построим
график зависимости скорости химической
реакции от температуры рис2..
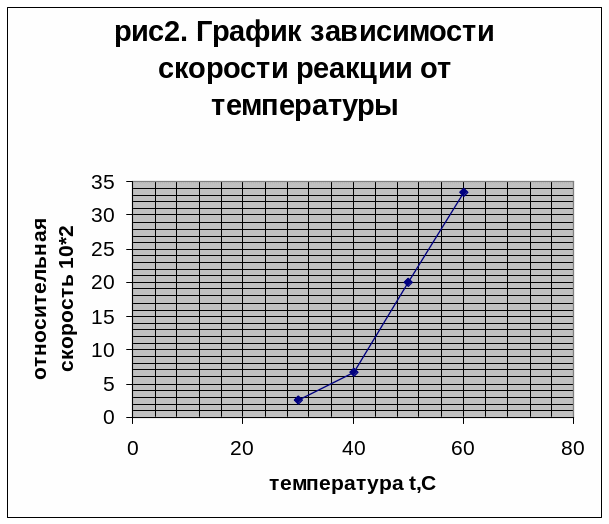
График скорости должен изображаться прямой линией. На графике получилась ломанная, это можно объяснить погрешностью в вычислениях, т.к. были округлены значения скорости и не точно найдено время.
Рассчитаем температурный коэффициент
для каждого опыта. Для этого из правила
Вант-Гофа
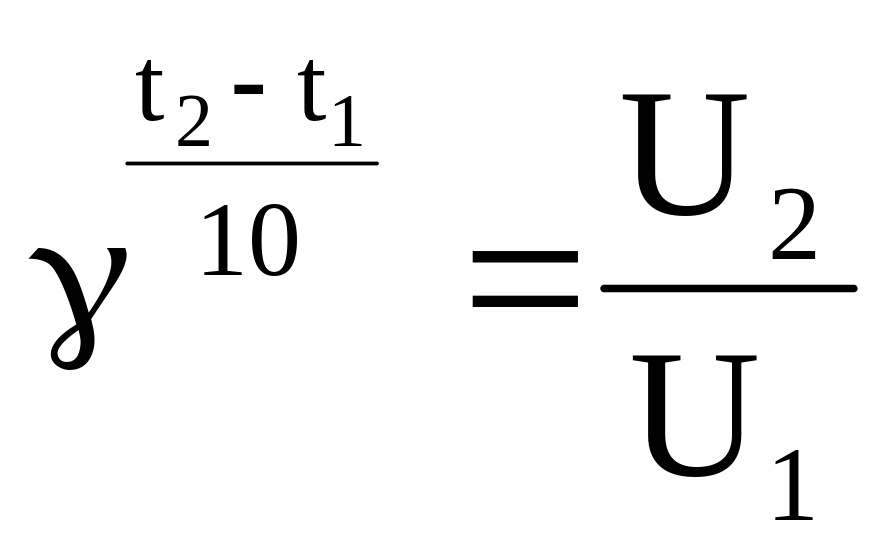 находим:
находим:
![]()
Теперь найдем среднее значение
температурного коэффициента:
![]() .
Из физического смысла температурного
коэффициента сдует, что температурный
коэффициент зависит от температуры,
при которой протекает реакция и от
природы взаимодействующих веществ.
.
Из физического смысла температурного
коэффициента сдует, что температурный
коэффициент зависит от температуры,
при которой протекает реакция и от
природы взаимодействующих веществ.
2.3 Вывод.
В ходе опыта установлено, что скорость
химической реакции зависит от температуры.
Так как при увеличении температуры
увеличивается доля активных молекул,
что приводит к увеличению эффективных
соударений молекул. Найденный в опыте
температурный коэффициент
![]() соответствует правилу Вант-Гофа
(находится в промежутке от 2 до 4).
Температурный коэффициент зависит
только от природы реагирующих веществ,
и показывает - во сколько раз увеличилась
скорость химической реакции при повышении
температуры на 100С.
соответствует правилу Вант-Гофа
(находится в промежутке от 2 до 4).
Температурный коэффициент зависит
только от природы реагирующих веществ,
и показывает - во сколько раз увеличилась
скорость химической реакции при повышении
температуры на 100С.
* * *
3. Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ.
3.1 Ход опыта.
В две пробирки нальем по ¼ объема
10%-ного раствора соляной кислоты
![]() .
Поместим в пробирки одновременно по
0,5 грамм мела и мрамора. Методом наблюдения
определим, в какой пробирке реакция
идет интенсивнее.
.
Поместим в пробирки одновременно по
0,5 грамм мела и мрамора. Методом наблюдения
определим, в какой пробирке реакция
идет интенсивнее.
3.2 Расчет и анализ экспериментальных данных.
Запишем уравнение реакции взаимодействия мела и мрамора с соляной кислотой:
![]() .
Признаком реакции является выделение
углекислого газа
.
Признаком реакции является выделение
углекислого газа
![]() .
Так как мел и мрамор имеют одинаковые
формулы, то эти реакции будут схожи,
однако в реакции с мелом, углекислый
газ будет выделяться в больших количествах.
Это обусловлено большее площадью
поверхности мела.
.
Так как мел и мрамор имеют одинаковые
формулы, то эти реакции будут схожи,
однако в реакции с мелом, углекислый
газ будет выделяться в больших количествах.
Это обусловлено большее площадью
поверхности мела.
3.3 Вывод.
В ходе лабораторного опыта было установлено, что скорость химической реакции зависит от величины поверхности реагирующих веществ. Это было установлено на примере взаимодействия соляной кислоты с мелом и мрамором. Так как у мела поверхность больше чем у мрамора, то в единицу времени реагирует большее количество веществ, выделение углекислого газа происходит интенсивнее, следовательно, реакция с мелом характеризуется большей скоростью химической реакции.
* * *
4. Влияние концентрации реагирующих веществ на состояние равновесия.
4.1 Ход работы.
Будем проводить опыт на примере
взаимодействия хлористого железа
![]() с роданидом калия
с роданидом калия
![]() .
.
Нальем в стакан 10 мл 0,01н раствора
и добавим 10 мл 0,01н раствора
.
Полученный раствор разделим на четыре
пробирки. В первую добавим 4-е капли
концентрированного раствора
,
во вторую 3-и капли концентрированного
раствора
,
в третью поместим немного твердого
![]() .
Встряхнем пробирки несколько раз для
ускорения реакции.
.
Встряхнем пробирки несколько раз для
ускорения реакции.
Таблица 3.
номер опыта |
добавленное вещество |
изменение интенсивности окраски (ослабление усиление) |
направление смещения равновесия( |
1 2 3 |
|
усиление усиление ослабление |
|
