
- •1. Зависимость скорости реакции от концентрации реагирующих веществ.
- •2. Зависимость скорости реакции от температуры.
- •2.1 Ход опыта.
- •2.2 Расчет и анализ экспериментальных данных.
- •3. Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ.
- •3.1 Ход опыта.
- •3.2 Расчет и анализ экспериментальных данных.
- •4. Влияние концентрации реагирующих веществ на состояние равновесия.
- •4.2 Расчет и анализ экспериментальных данных.
- •5.Влияние температуры на состояние равновесия.
- •5.1 Ход опыта.
- •5.2 Расчет и анализ экспериментальных данных.
4.2 Расчет и анализ экспериментальных данных.
Запишем уравнение реакции взаимодействия
хлористого железа
с роданидом калия
:
![]() .
Так как реакция обратима, то при смещения
равновесия в следствии изменения
концентрации реагирующих веществ
интенсивность красного окрашивания
раствора, обусловленного образованием
роданида железа
.
Так как реакция обратима, то при смещения
равновесия в следствии изменения
концентрации реагирующих веществ
интенсивность красного окрашивания
раствора, обусловленного образованием
роданида железа
![]() ,
будет смещаться. Для выяснения направления
смещения равновесия запишем константу
равновесия реакции (из закона действия
масс для обратимых реакций):
,
будет смещаться. Для выяснения направления
смещения равновесия запишем константу
равновесия реакции (из закона действия
масс для обратимых реакций):
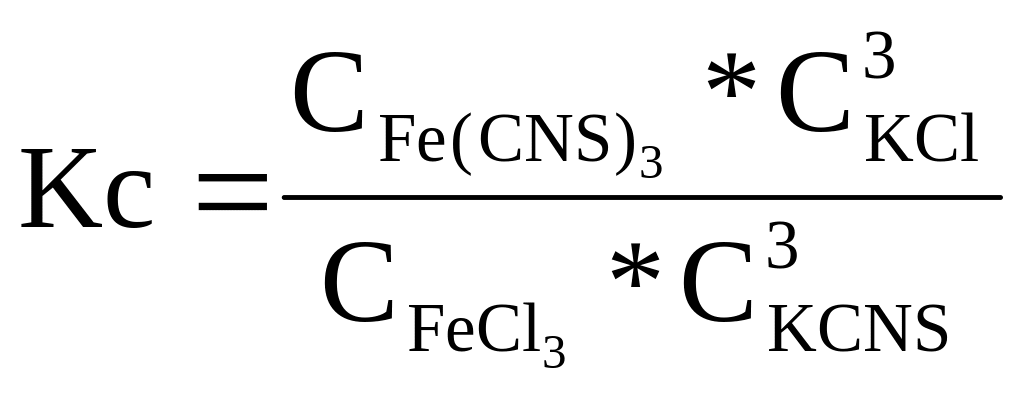 .
В первом опыте добавляем хлористое
железо
,
происходит усиление окраски, следовательно
равновесие смещается в сторону продуктов
реакции. То же самое просидит и во втором
опыте при добавлении роданида калия
.
А при добавлении калий хлора
в третьем опыте, окраска переходит с
красного в ярко рубиновый цвет, то есть
окраска слабеет, следовательно, равновесие
смещается в сторону исходных веществ.
.
В первом опыте добавляем хлористое
железо
,
происходит усиление окраски, следовательно
равновесие смещается в сторону продуктов
реакции. То же самое просидит и во втором
опыте при добавлении роданида калия
.
А при добавлении калий хлора
в третьем опыте, окраска переходит с
красного в ярко рубиновый цвет, то есть
окраска слабеет, следовательно, равновесие
смещается в сторону исходных веществ.
4.3 Вывод.
В ходе лабораторного опыта было установлено, что концентрация реагирующих веществ оказывает влияние на состояние равновесия. Это происходит по принципу Лье – Шателье: оказав на систему, находившуюся в равновесии, какое либо внешнее воздействии, равновесие смещается в сторону ослабления этого действия. В нашем случае была изменена концентрация веществ. Это было установлено на примере реакции взаимодействия хлористого железа с роданидом калия .
* * *
5.Влияние температуры на состояние равновесия.
5.1 Ход опыта.
В пробирку нальем 5 мл раствора крахмала
и добавим несколько капель 0,1н раствора
йода
![]() до появления синего окрашивания. Нагревая
пробирку с раствором, а потом, охлаждая
ее до комнатной температуры, будет
происходить изменение окраски раствора.
до появления синего окрашивания. Нагревая
пробирку с раствором, а потом, охлаждая
ее до комнатной температуры, будет
происходить изменение окраски раствора.
5.2 Расчет и анализ экспериментальных данных.
В реакции взаимодействия крахмала с
йодом образуется йодокрахмал - синего
цвета, то об изменении равновесия
реакции можно судить по изменению
окраски раствора. Так как эта реакция
является экзотермической (![]() ),
то при повышении температуры скорость
реакции будет уменьшаться, окраска
раствора будет слабеть. По этому
результату можно сказать, что равновесие
смещается влево, в сторону исходных
веществ.. Это происходит по принципу
Лье – Шателье: при повышении температуры
равновесие смещается всегда в сторону
эндотермического процесса, который
идет с поглощением температуры
),
то при повышении температуры скорость
реакции будет уменьшаться, окраска
раствора будет слабеть. По этому
результату можно сказать, что равновесие
смещается влево, в сторону исходных
веществ.. Это происходит по принципу
Лье – Шателье: при повышении температуры
равновесие смещается всегда в сторону
эндотермического процесса, который
идет с поглощением температуры
5.3 Вывод.
В ходе лабораторного опыта было установлено, что температура влияет на состояние равновесия химической реакции. При повышении температуры в экзотермической реакции ( ) равновесие будет смещаться в сторону исходных веществ. Это происходит по принципу Лье – Шателье, и было выполнено на реакции взаимодействия крахмала с йодом.
