
Электрохимические процессы
.docЭлектрохимические процессы
Электрохимические процессы, в основе которых лежит непосредственное воздействие электрического тока на вещество и получение в результате этого необходимых продуктов, занимают видное место в химической промышленности. Одним из наиболее распространенных электрохимических процессов является электролиз растворов или расплавов.
Электролиз - окислительно-восстановительные процессы, протекающие на электродах под действием постоянного электрического тока при его пропускании через растворы или расплавы электролитов. На поверхности положительного электрода (анода) ионы электролита отдают электроны, т.е. окисляются; на поверхности отрицательного электрода (катода) происходит присоединение электронов, т.е. восстановление ионов.
Электрохимические процессы описывают законы Фарадея:
1) количество вещества, прореагировавшего на электроде, пропорционально силе тока J и длительности электролиза Δτ (т.е. пропорционально количеству прошедшего через электролит электричества q);
2) при постоянном количестве пропущенного электричества массы прореагировавших веществ тi пропорциональны их химическим эквивалентам Эi. При пропускании через электролит количества электричества, равного числу Фарадея F (F = 96485 Кл = 26,8 А·ч), на электроде выделяется один эквивалент вещества.
О![]() ба
закона можно выразить общей формулой,
позволяющей рассчитать теоретическую
массу вещества, выделяющегося на
электроде при пропускании через
электролит электричества
ба
закона можно выразить общей формулой,
позволяющей рассчитать теоретическую
массу вещества, выделяющегося на
электроде при пропускании через
электролит электричества
(4.1)
В реальных условиях при протекании процессов электролиза масса выделяющегося на электроде вещества меньше теоретической, рассчитанной по законам Фарадея. Это связано как с протеканием наряду с целевым электродным процессом побочных реакций на электродах, так и с вторичными взаимодействиями целевых продуктов электролиза друг с другом или с раствором электролита.
По количеству полученного целевого продукта электролиза можно рассчитать полезно израсходованную часть тока. Эта часть тока, выраженная в долях единицы или процентах, называется выходом по току η.
Если известно количество электричества (произведение силы тока на время), прошедшее через электролит, то по законам Фарадея можно найти теоретическую массу целевого продукта mt , которая должна была бы выделиться на электроде при отсутствии побочных реакций. Фактически полученная масса целевого продукта пропорциональна той части тока, которая затрачена на целевую электродную реакцию,
Поэтому выход по току можно определить как отношение фактически полученной массы целевого продукта к теоретической
![]()
(4.2)
Выход по току является одним из важнейших технологических показателей электрохимических процессов. Об эффективности электролиза судят также по доле полезно затраченной электроэнергии.
Разряд ионов может начаться в том случае, если к электроду приложен потенциал, превышающий равновесный.
Равновесный электродный потенциал φe рассчитывают по уравнению Нернста
![]()
(4.3)
где φ° - стандартный потенциал, значения которого для некоторых электродных реакций приведены в табл. 4.1; R - универсальная газовая постоянная (R = 8,314 Дж-моль-1К-1); Т - температура, К; n - число электронов, участвующих в электродной реакции; аОК и аВОССТ - активности окисляемых или восстанавливаемых ионов соответственно, моль/л (в первом приближении их можно принять равными концентрации ионов в растворе).
Таблица 4.1
Стандартные электродные потенциалы в водных растворах
(Т =298 К, С =1 моль/л)
|
Электродная реакция |
φ°,В |
|
Na+ + e- ↔Na |
-2,714 |
|
Н+ + е- ↔ 1/2Н2 |
± 0,000 |
|
2ОН- - 2е- ↔ O + Н20 |
+ 0,401 |
|
Cl- -e- ↔ l/2Cl2 |
+ 1,360 |
Н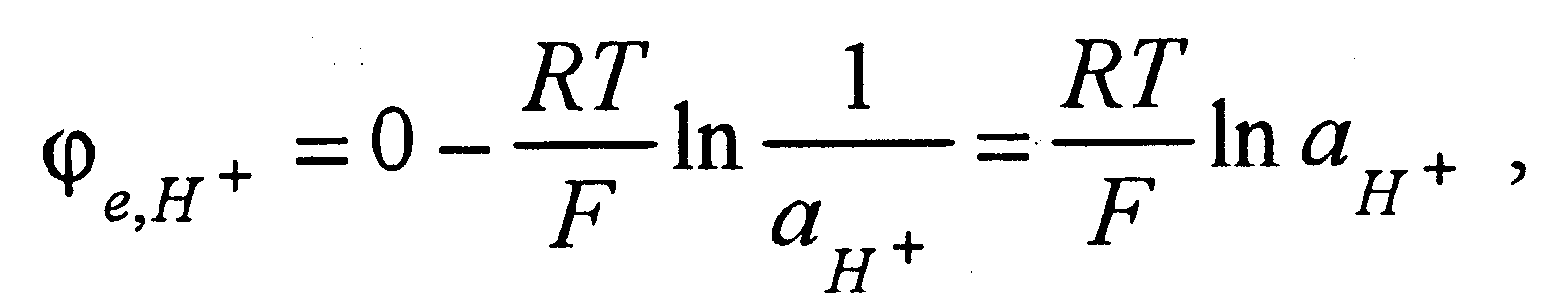 апример,
при протекании на катоде реакции
восстановления ионов водорода
равновесный потенциал может быть
рассчитан по формуле
апример,
при протекании на катоде реакции
восстановления ионов водорода
равновесный потенциал может быть
рассчитан по формуле
(4.4)
а при протекании на аноде реакции окисления ионов хлора
![]()
(4.5)
Теоретическое напряжение электролиза находят как разность равновесных потенциалов анода и катода
![]() (4.6)
(4.6)
У![]() равнение
(4.6) определяет величину напряжения,
которое необходимо подать на электроды
в условиях равновесия, когда заряженные
частицы находятся вблизи электрода. В
реальных неравновесных электродных
процессах ионам, поступающим из раствора,
необходимо преодолеть ряд сопротивлений,
прежде чем произойдет электрохимическая
реакция на электроде. Поэтому для того,
чтобы процесс электролиза начался, к
электродам требуется подвести напряжение
UФ, большее чем
UТ.
Фактическое напряжение UТ
складывается из следующих
составляющих:
равнение
(4.6) определяет величину напряжения,
которое необходимо подать на электроды
в условиях равновесия, когда заряженные
частицы находятся вблизи электрода. В
реальных неравновесных электродных
процессах ионам, поступающим из раствора,
необходимо преодолеть ряд сопротивлений,
прежде чем произойдет электрохимическая
реакция на электроде. Поэтому для того,
чтобы процесс электролиза начался, к
электродам требуется подвести напряжение
UФ, большее чем
UТ.
Фактическое напряжение UТ
складывается из следующих
составляющих:
(4.7)
где ΣφП - сумма перенапряжений на аноде и катоде (величина анодной и катодной поляризации, зависящая от материала электрода и типа разряжающегося иона); ΣJR - сумма падений напряжений в электролите, на диафрагме, контактах и в подводящих проводах.
Величина напряжения определяет затраты электрической энергии на процесс. Эффективность ее потребления находят по коэффициенту использования электроэнергии.
Коэффициентом использования электроэнергии μ называют отношение теоретически необходимой энергии для выделения единицы массы продукта wт к действительно затраченной энергии WФ
Теоретический расход электроэнергии на выделение единицы массы продукта рассчитывают по формуле
![]()
Ф![]() актические
затраты энергии на выделение единицы
массы продукта составляют
актические
затраты энергии на выделение единицы
массы продукта составляют
Следовательно,
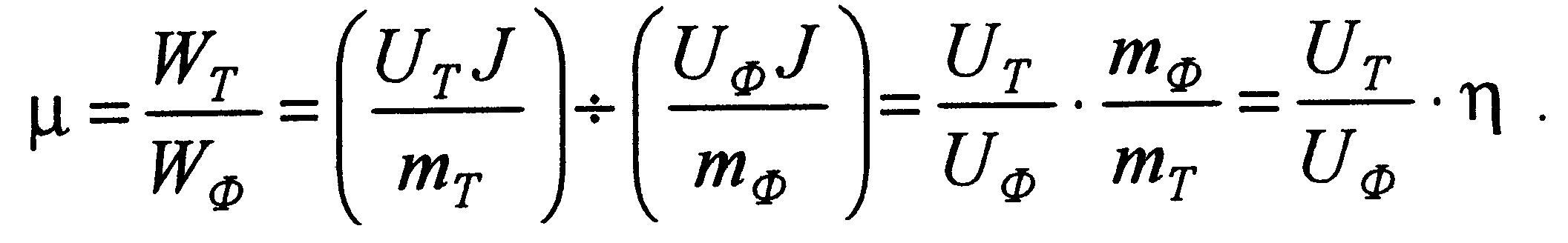
(4.8)
