
Московский Государственный Университет
Инженерной Экологии
Кафедра ОИЭ и ХТ
Группа Н-40
Студент Веселов Д.И.
Дата работы 24.10.03
Лабораторная работа №6
Периодический реактор идеального смешения
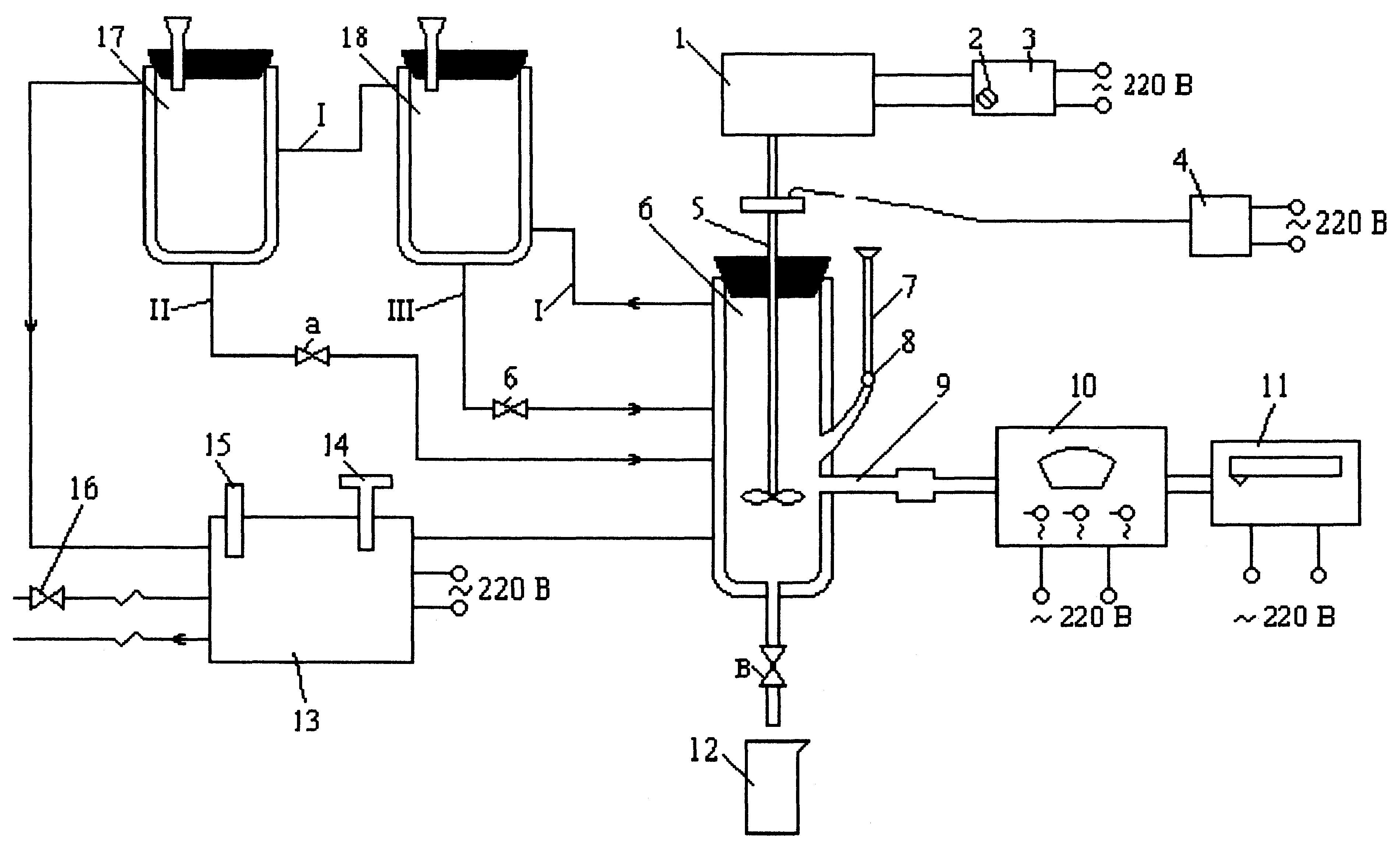
Таблица 5.1
Исследование кинетики реакции омыления этилацетата
|
τ,с |
СB, кмоль/м3 |
CA, кмоль/м3 |
Расчет по МНК | |
|
|
|
|
СAрасч |
ε |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 5.2
Результаты обработки экспериментальных данных
|
Номер эксперимента |
Т, К |
Μ=сB,0/сA,0 |
k1, м3с-1моль-1 |
ε |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
8 |
|
|
|
|
|
9 |
|
|
|
|
|
10 |
|
|
|
|
|
11 |
|
|
|
|
|
12 |
|
|
|
|
Цель работы- исследование кинетики химических реакций в периодическом реакторе идеального смешения, определение константы скорости химической реакции и энергии активации.
Теоретические основы
Удобным объектом для изучения особенностей кинетики химических превращений является реактор смешения периодического действия.
Режим идеального смешения характеризуется следующими допущениями:
- мгновенное изменение и выравнивание технологических параметров по объему реактора;
- равенство значений технологических параметров на выходе и в объеме реактора.
На основании сформулированных допущений можно записать определение модели идеального смешения для исходного компонента А:
![]()
где CA,0; CA иСA,f- концентрация веществаАначальная, текущая и конечная соответственно.
В периодическом реакторе идеального смешения в соответствии с допущениями идеальности значения концентрации реагентов, степени превращения, температуры, скорости реакции и других параметров в любой момент времени будут одинаковы во всех точках реактора, однако значения тех же параметров для одной и той же точки в разные моменты времени будут отличаться (рис. 5.1). Таким образом, процесс, протекающий в периодическом реакторе, является нестационарным.
Для определения кинетических параметров химической реакции может быть использовано уравнение материального баланса реактора идеального смешения периодического действия
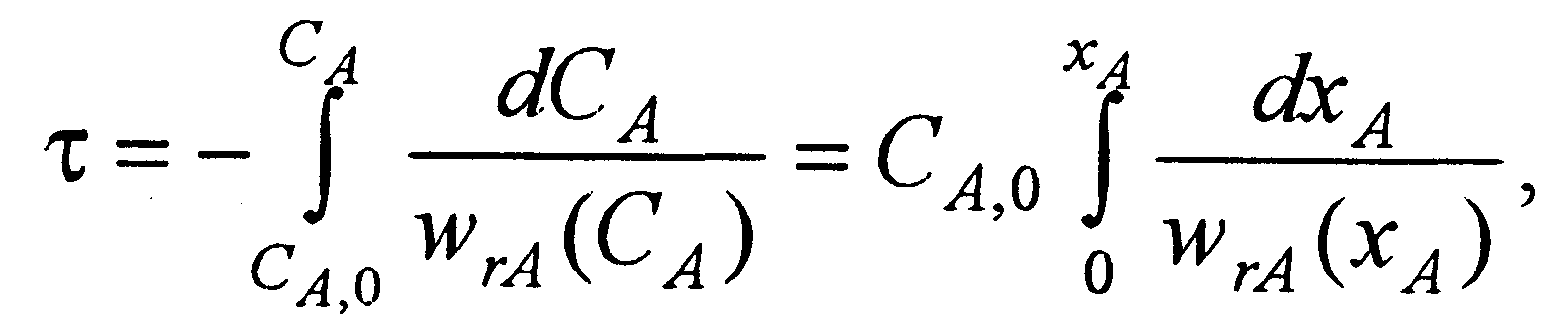
(5.1)
где τ -время пребывания реакционной смеси в реакторе, необходимое для достижения степени превращения реагента xA ; wrА(СA)илиwrA(xA)- кинетическое уравнение реакции.
В данной работе изучают кинетику реакции второго порядка - омыления щелочью этилового эфира уксусной кислоты (этилацетата - ЭТА):
СН3СООС2Н5+NaOH→CH3COONa+ C2H5OH
(A + B → R + S) (5.2)
Кинетическое уравнение такой реакции имеет вид
wrA = kCACB = kСA(CB,0 – СA,0 + СA) (5.3)
где k -константа скорости химической реакции.
Представим уравнение (5.3) в виде
wrA = kf(CA)
Тогда уравнение (5.1) можно записать как
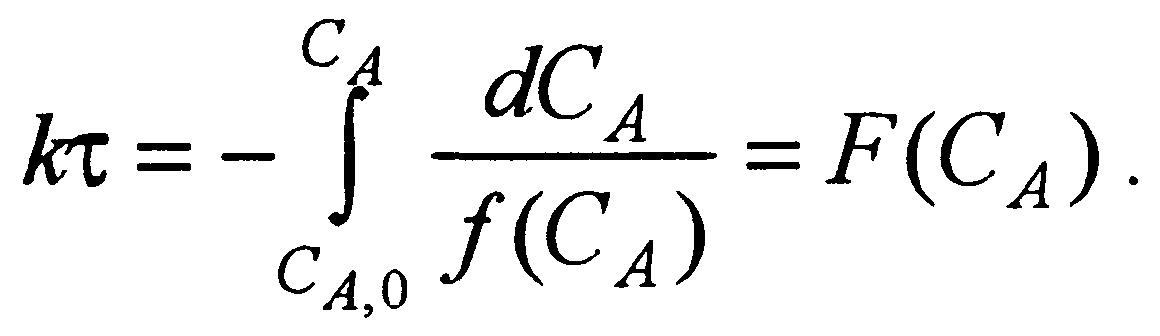
(5.4)
В соответствии с уравнением (5.4) зависимость между F(CA)и τявляется линейной; по величине тангенса угла наклона прямой линии можно определить константу скорости реакции.
Для этого по полученным в эксперименте значениям концентраций реагентов в разные моменты времени строят зависимость
F(C) = φ(τ).

Рис. 5.1. Характеристики периодического реактора идеального смешения
Так как экспериментальные точки обычно характеризуются некоторым разбросом, то при построении линейной зависимости целесообразно использовать метод наименьших квадратов (МНК). Конкретный вид функции для необратимой химической реакции второго порядка зависит от того, взяты ли реагенты в стехиометрическом соотношении или нет.
Если щелочь взята в избытке по отношению к этилацетату в Μраз, т.е.СB,0/СA,0 = М, то с учетом стехиометрических соотношений можно записать
СB=СB,0–СA,0 +СA =СA,0 (М - хA) (5.5)
Тогда
wrA = kC2A,0(1 - xA)(M - xA) (5.6)
Уравнение материального баланса (5.1) после соответствующей подстановки примет вид
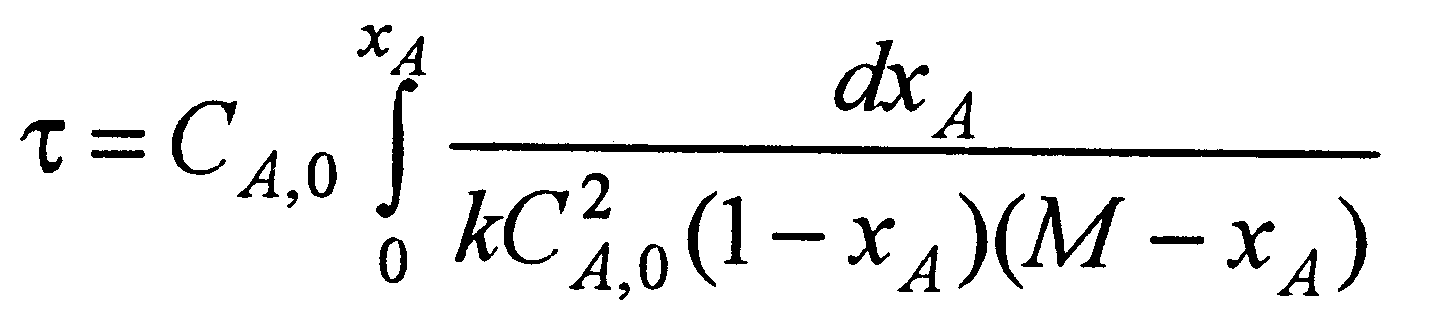
(5.7)
После интегрирования уравнения (5.7) получим
kτ = F1(СB), (5.8)
где
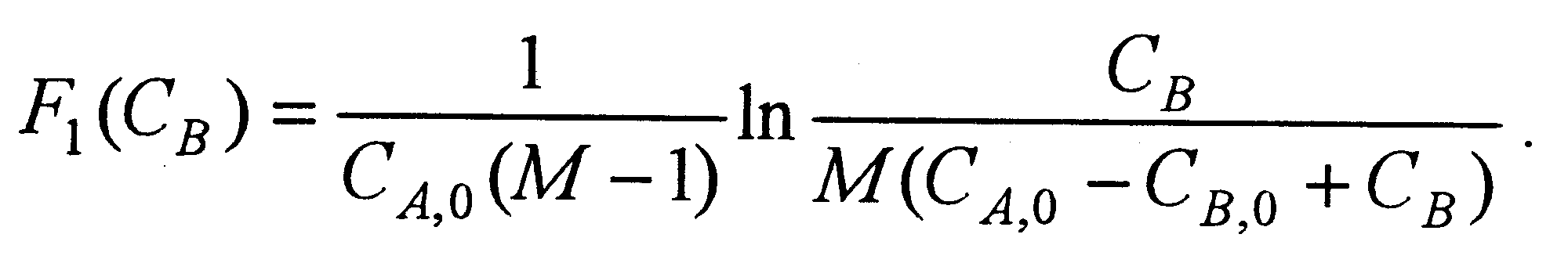
В координатах F1(СB) - τдля реакции второго порядка (в случае M ≠ 1) экспериментальные точки должны находиться на прямой линии, тангенс угла наклона которой равенk (рис. 5.2).
Для случая CA,0 = СB,0кинетическое уравнение реакции можно записать в виде
wrА=kCА2 (5.9)
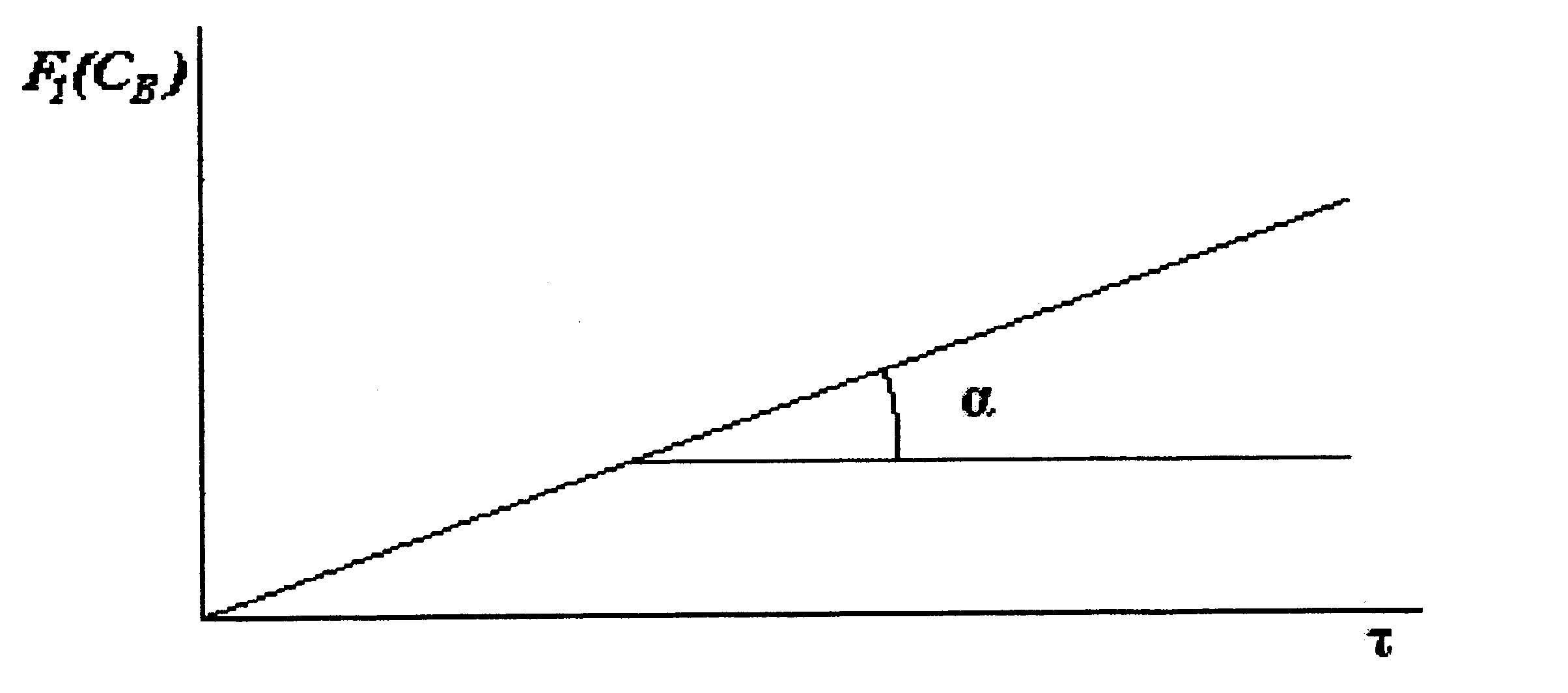
Рис. 5.2. Зависимость F1(СB) от времени пребывания реагентов в периодическом реакторе
После подстановки уравнения (5.9) в уравнение материального баланса (5.1) получаем
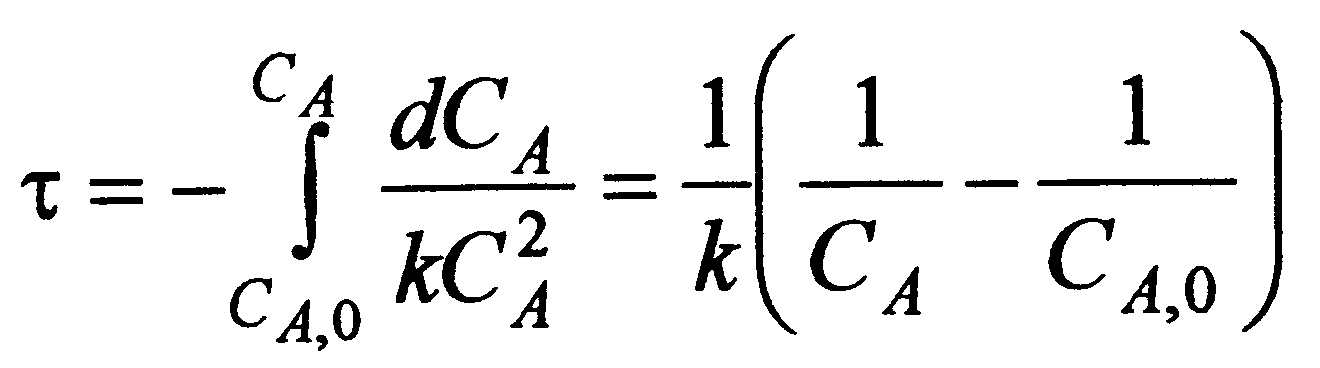
(5.10)
или
![]()
(5.11)
Уравнение (5.11) представляет собой прямую линию в координатах 1/СA- τ,отсекающую на оси ординат отрезок1/СA,0 (рис. 5.3).
Построив по экспериментальным точкам в этих координатах прямую линию, по тангенсу угла наклона находим значение константы скорости k.
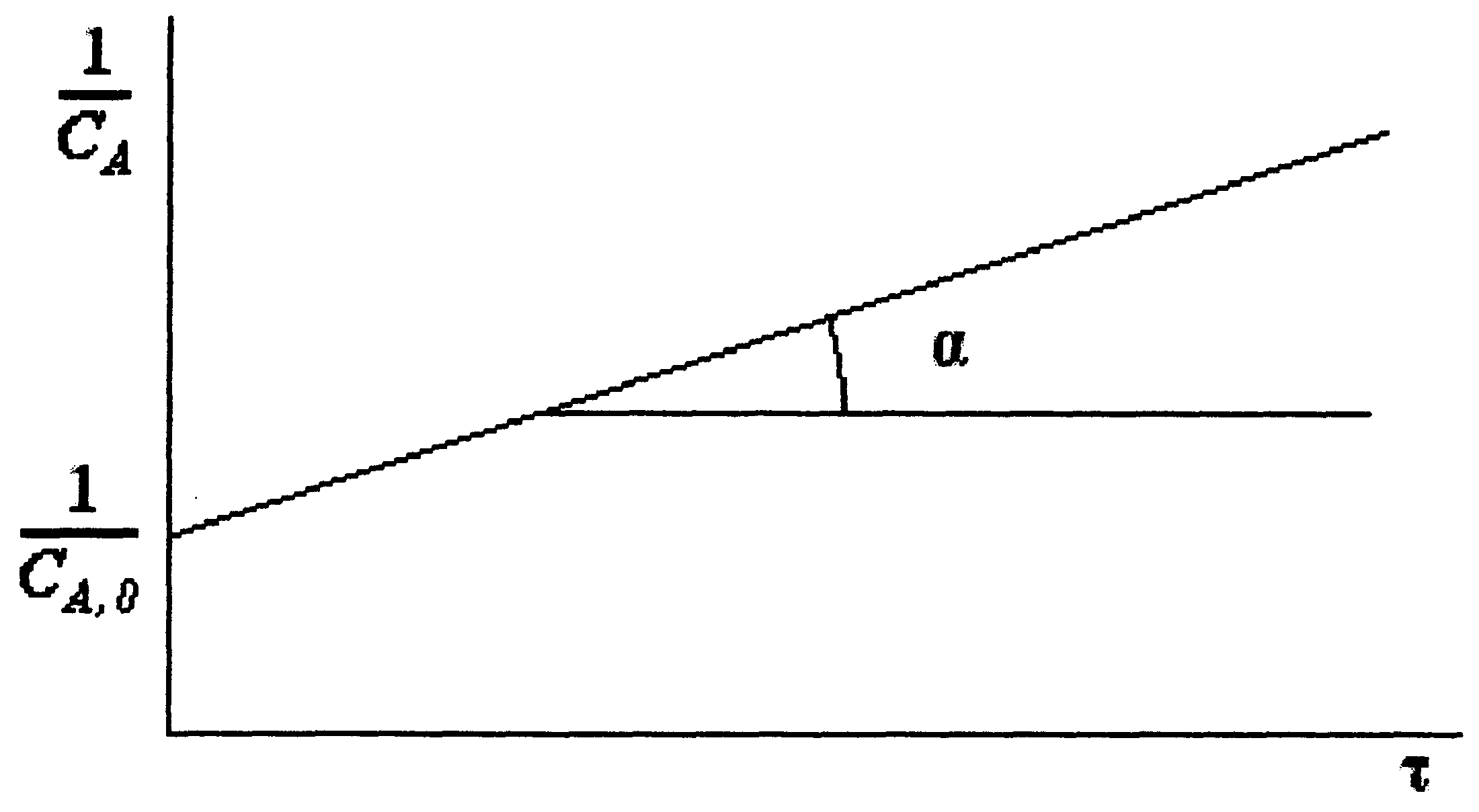
Рис. 5.3. К определению константы скорости реакции для опытов со стехиометрической смесью реагентов
Для определения энергии активации Εиспользуем уравнениеАррениуса
![]()
(5.12)
Построив линейную зависимость Ink = f(1/T),можно рассчитать энергию активации по величине тангенса угла наклона этой прямой
tgα= -E/R,
где R= 8,314 Дж-моль-1К-1.
