
Люминесценция и флюорометрия
.docЛюминесценция и флюорометрия
Многие органические и неорганические вещества способны к самостоятельному свечению, возникающему под различными воз- действиями. Это явление получило название люминесценции. По характеру процессов, вызывающих люминесценцию, различают:
-
фотолюминесценцию (возбуждение видимым или ультрафиолетовым светом);
-
хемилюминесценцию (возбуждение за счет энергии химических реакций);
-
катодолюминесценцию (возбуждение электронным ударом);
-
термолюминесценцию (возбуждение нагрева- нием);
-
триболюминесценцию (возбуждением механическим воз- действием). В химическом анализе имеют значение первые два вида люминесценции.
Люминесценцию также классифицируют по наличию послесве- чения. Она может прекращаться сразу при исчезновении возбужде- ния — флюоресценция или продолжаться определенное время после прекращения возбуждающего воздействия — фосфоресценция. В хи- мическом анализе в основном используют явление флюоресценции, поэтому метод назван флюориметрией. В разработку теории люми- несценции большой вклад внес советский ученый С. И. Вавилов.
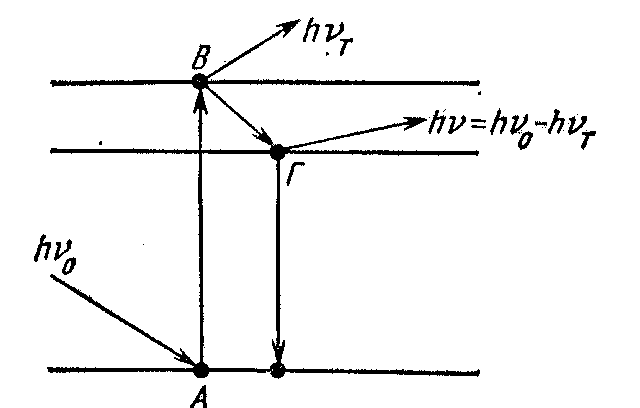
Люминесценция возникает как следствие поглощения веществом квантов hv0, электромагнитного излучения и возбуждения его моле- кул или атомов. Перейдя в возбужденное состояние В, молекула или атом вещества через некоторое время (~10-12 с) возвращается в основное состояние А, излучив избыточную энергию в виде кван- тов. При этом часть энергии излучается сначала в виде кванта теплового излучения hvT, что приводит к определений стабилиза ции молекулы на нижнем возбужденном уровне Г, затем происхо- дит излучение кванта hv В- или УФ-области спектра, сопровожда- ющееся переходом в основное состояние (рис. 1). В связи с этим - серия (частота) флуоресцентного излучения меньше энергии (частоты) возбуждающего излучения (за счет теплового излучения). Это явление названо законом Стокса по имени ученого, открывшего
его. Способностью к флюоресценции обладают некоторые ионы металлов (уран), многие комплексы и органические (в основном ароматические) соединения.
Основными характеристиками флюоресценции являются вели- чины квантового и энергетического выхода, а также спектр флюорес- ценции. Квантовый выход — это отношение числа излученных мо- лекулой квантов Nизл к числу поглощенных Nпог. Энергетический выход — отношение величин излучаемой Еизл и поглощаемой Епог энергии. Квантовый Вкв и энергетический Вэн выход взаимосвя- заны через частоты v или длины волн излучаемого и поглощаемого света.
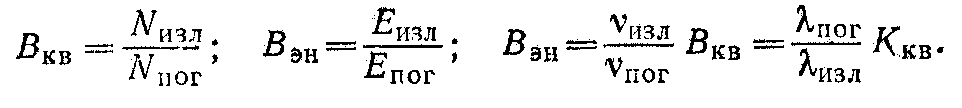
Квантовый выход флюоресценции в общем случае зависит от длины волны возбуждающего излучения, но спектр флюоресценции от длины волны возбуждающего излучения не зависит и является характеристикой вещества.
ис.
47. Механизм возникновения
флюоресценции
В аналитической химии имеют дело преимущественно с раство- рами флюоресцирующих веществ. Интенсивность флюоресценции зависит от концентрации вещества и связана с квантовым и энерге- тическим выходами, длиной волны возбуждающей радиации, тем- пературой раствора, присутствием в растворе посторонних веществ, величиной рН раствора, природой растворителя. При изменении этих факторов может происходить как усиление флюоресценции, так и ее ослабление или гашение. Последнее происходит вследствие того, что излучаемая энергия передается молекулам других веществ, находящимся в растворе, и флюоресценция не возникает. При уве- личении температуры происходит так называемое температурное гашение. При высоких концентрациях возникает явление концентра- ционного гашения флюоресценции. Присутствие в растворе посто- ронних примесей также может привести к гашению. Для боль- шинства флюоресцирующих веществ характерен свой интервал значений рН раствора, при которых возникает флюоресценция.
Флюоресцентные методы анализа делятся на прямые и косвен- ные. К прямым методам относятся такие, в которых непосред- ственно измеряется интенсивность флюоресценции. В косвен- ном флюоресцентном анализе флюоресценция служит индика- тором, указывающим окончание процесса определения вещества. Методы прямого флюоресцентного анализа основаны на законе С. И. Вавилова, согласно которому в области малых концентраций (10-7 — 10 -4 моль/дм3) интенсивность флюоресценции Ф раствора линейно зависит от концентрации С: Ф = КС. При увеличении концентрации раствора линейность нарушается вследствие гаше- ния флюоресценции или уменьшения ее интенсивности. Здесь ана- литические определения сопряжены с большой погрешностью и, как правило, не проводятся.
Прямыми флюоресцентными методами количественно могут опре- деляться в растворе вещества, обладающие собственной флюорес- ценцией (определение витамина В1); образующие с различными реагентами флюоресцирующие соединения (определение Al+3 по его комплексу с салицилаль-о-аминофенолом); гасящие флюоресцен- цию различных реагентов, связывая их в нефлюоресцирующие соеди- нения (определение Zn2+ по гашению флюоресценции родамин (С)— тиоцианата, который связывается с цинк-ионами).
В качестве реагента на нефлюоресцирующий катион может использоваться соединение, спектр флюоресценции которого ме- няется в результате взаимодействия с анализируемым веществом. Например, соединение цинка с семикарбазоном салицилового альде- гида флюоресцирует синим цветом, тогда как сам реагент — желто- зеленым.
Разновидностью флюоресцентного метода является экстрак- ционно-флюоресцентный метод, при котором обра- зующееся соединение из водного раствора экстрагируется органи- ческим растворителем, затем измеряется интенсивность флюорес- ценции экстракта. Таким способом определяют содержание алю- миния, получая его оксихинолят, который затем экстрагируют хлороформом. Интенсивность флюоресцепции хлороформного эк- стракта измеряют на флюориметре.
Измерение флюоресценции осуществляют при помощи серийных фотоэлектрофлюориметров, состоящих из источника возбуждающего
излучения 1 (ртутно-кварцевая лампа), светофильтра 2, кюветы 3, в которую помещают анализируемый раствор; приемников флюо- ресцентного излучения 4 (фотоэлемент), усилителя 5 и измеритель- ного прибора 6 (рис. 2). Приемники флюоресценции располагают перпендикулярно направлению распространения возбуждающего излучения, чтобы первичное излучение не накладывалось на флюо- ресценцию. Производятся флюориметры ФМ-1, ФАС-М, КФЛ-2-1. Для регистрации спектров флюоресценции применяют спектро- флюориметры, в которых излучение вещества поступает на спектро- фотометр. Серийно выпускается спектрофлюориметр «Нева». Изме- ряют флюоресценцию обычно в относительных единицах, например в единицах показаний фотоэлемента или фотоэлектроумножителя.
При проведении флюоресцентного анализа пользуются калиб- ровочным графиком, для построения которого определяют интен- сивность флюоресценции серии стандартных растворов. Для дости- жения этой же цели может использоваться сравнение интенсив- ности флюоресценции анализируемого и эталонного растворов.
Из косвенных методов флюориметрического анализа получило распространение титрование с помощью флюоресцентных индика- торов.
Окислительно-восстановительные флюоресцентные индикаторы изменяют интенсивность или цвет флюоресценции в зависимости от окислительно-восстановительного потенциала системы. Напри- мер, при титровании Fe2+ раствором сульфата церия в присутствии индикатора силоксена (Si6H6O3)n флюоресценция раствора исчезает в присутствии небольшого избытка титранта.
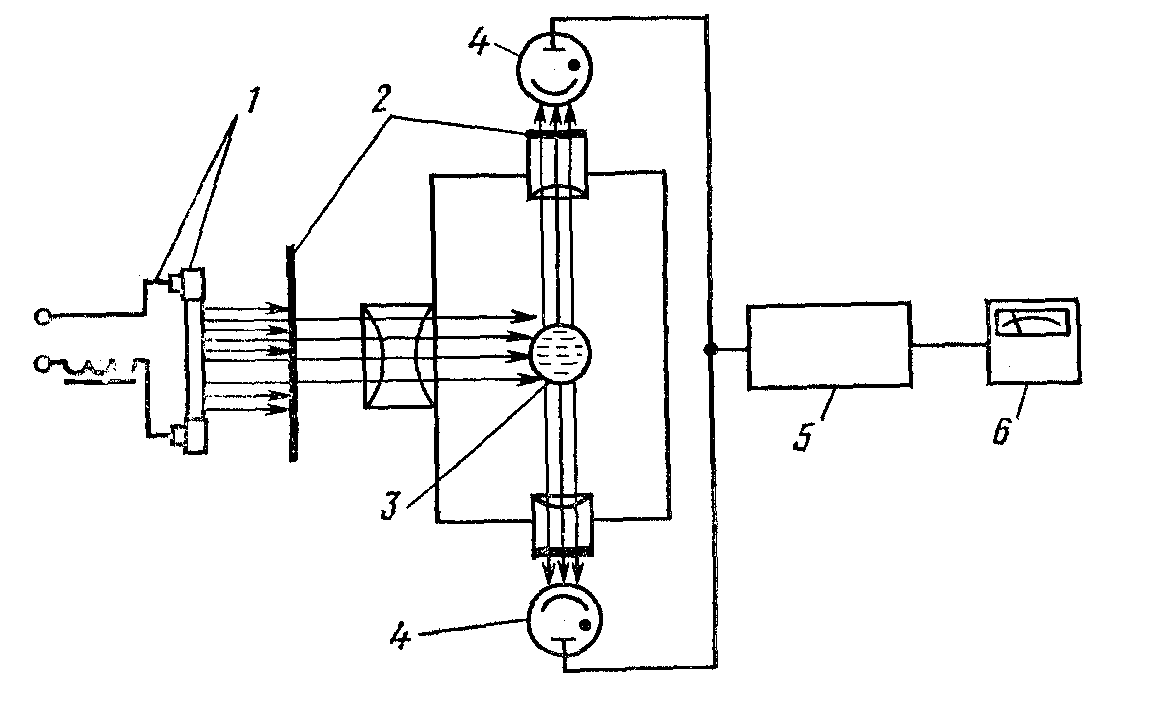
Рис. 2. Схема флюориметра

В химии и фармации флюориметрию используют для анализа следов металлов, органических (ароматических) соединений, витами- нов D, В1,флюоресцентные индикаторы применяют при титрова- нии в мутных или темно-окрашенных средах. Процесс титрования ведут в темноте, освещая титруемый раствор, куда добавлен инди- катор, светом люминесцентной лампы. Так же флюорометрию с помощью люминесцентной лампы можно опреднлять качество продуктов, питьевой воды, наличие болезнетворных организмов.
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНЖЕНЕРНОЙ ЭКОЛОГИИ
Кафедра физической химии
Доклад по физической химии на тему
люминесценция
Студент ЯКУНИН П.В.
Группа И – 35
Преподаватель МИШУСТИН А.И.
МОСКВА - 2003
